法诺共振不对称超材料的超灵敏光谱和单分子层识别
Chihhui Wu, Alexander B.Khanikaev,Ronen Adato,Nihal Arju
工程光学超材料为生物传感应用提供了一个独特的平台,因为它们拥有光谱选择能力并且能够将光限制在纳米量级。红外等离子体超材料特别有吸引力,因为它们的共振响应可以精确地调谐到目标生物分子的振动模式。我们在这里介绍了一种基于法诺共振的非对称超材料的红外等离子表面,并在此基础上产生了子波的干涉和超辐射等离子体共振,从而引起了尖锐的共振。由于超材料的不对称性,可以精确地确定并与分子的振动特性相匹配的子波共振频率。一种多像素的法诺共振非对称超材料阵列,被用作纳米级单分子识别蛋白及其表面方向的多光谱生物传感的平台,同时也用于检测目标抗体与识别蛋白的化学结合。
对生命维持生物分子结合过程的深度理解有可能影响生命科学和医学的每一个角落。一般来说,在生物分子结构中,构象重新排列需要匹配宿主和客体分子之间的结合位点。然而,先进的生物传感技术只能探测生物材料的积累,这是因为分子结合的缘故而不是结合过程所需要的不充分的构象变化。虽然表面增强了拉曼和红外吸收光谱,光谱可以提供分子构象状态的振动信号,但这些光谱方法与“黄金标准”的生物传感技术并不直接兼容。因为二者的工作原理基本不同。在这里,我们介绍了一种基于等离子体共振不对称超材料(FRAMMs)的结构解决无标签的生物传感技术,它可以通过利用生物分子频率相关的红外响应的全部信息内容,来同时探测生物分子相互作用的结构和结合特征。
等离子体超材料是经过精心设计的人工介质,具有特定的电磁响应,覆盖范围广泛的频率:从可见光范围到THz范围。它们的光学性能超越了自然生成的光学材料所能达到的范围,拥有许多奇异的现象,包括负折射率、强手性(螺旋特性)和不确定的电子感应率。超材料显示了这些不寻常的光学特性,通常由高度共振的等离子体元素(例如,分裂环谐振器)组成,它们具有光谱窄的响应和较强的局部场集中。由于这些特性,等离子体超材料和单分子最近成为了一种强大的光子平台,用于传感应用,并已被用于线性和非线性表面光谱增强。
对生物传感尤其重要,其应用是红外线超材料,因为生物分子拥有中红外振动特性可以用于识别,从而改善特异性生物检测。
然而,将超材料共振的概念与一个生物分子的特定振动线相共振的概念相比较是直接的,而其实际的实现方法则是由于红外活动振动的密集光谱间隔而变得复杂。例如,有选择性地将共振的超材料调到蛋白质主干的常用氨基化合物的振动(氨基化合物,=1620-1680 和氨基化合物Ⅱ,在=1510-1580 )需要结构的质量因子q~ 10。甚至可能需要更窄的共振来解决二级蛋白质结构。大多数等离子体超材料都很难获得如此尖锐的共振线。即使在红外频率下有着相对较低的欧姆损耗。窄线宽也是在平面等离子体的表面上获得大场增强的必要条件。例如,半波天线既不提供强场增强,也不提供光谱窄的响应。通过将元分子排列成周期性阵列,有可能可以抑制辐射衰减,促进场增强,这是由于集体的高质量共振的形成。这种相干的超材料的缺点是,它们依赖于单元细胞之间的长期相互作用,使它们的性能对制造出的缺陷和红外光束的角扩散很敏感。
最近出现的另一个实现窄光谱响应和高场增强的方法是基于法诺共振的。法诺共振的方法依赖于生物分子的本身共振并且因此避免了结合分子材料的缺点。法诺共振起源于两个电磁特征模式之间的干扰,被称为一个多共振的元分子的“超辐射”和“子辐射”。这种具有高质量因数的结构可以用于定量的生物传感,但因为依赖于频率无关的蛋白质折射指数所以会由于缺乏分子特异性。下面介绍的基于FRAMM的平台可以对纳米尺度的多分子纳米组件进行定量的生物传感和指纹识别,并有可能对目前探测技术无法获得的广泛的生物分子相互作用的底层机制进行研究。通过将单个阵列元素调整为(远离)蛋白质的振动共振,我们分别研究了纳米尺度蛋白单分子的结构/光谱和结合特性。例如,后者能够准确地确定整体单层厚度,而前者提供关于蛋白质的方向或构象状态的非常具体的信息。FRAMM的本构元生物分子的不对称性使得法诺共振的光谱位置得到精确的实验测定,而共振场增强极大地促进了到红外信号范围的蛋白质结构和结合属性。我们通过在一个定义良好的超细的多蛋白层(一种目标蛋白单层细胞沉积在一个识别单层)上进行测试证明了基于FRAMM的多像素基板的生物传感和指纹识别能力。具体来说,我们将演示(1)振动指纹识别和测量识别蛋白质的厚度(蛋白质A / G),(2)检测抗体(从山羊检测到的anti-mouse IgG )结合到固定的蛋白质表面,抗体的单层厚度的决定使用作为分子尺度(3)空间定位测定的蛋白质对金属表面正常。最后的信息对于决定生物目标的功能可用性是至关重要的。当由焦平面阵列(FPA)探测器平行获取多个红外光谱的标准技术应用于基于多像素的功能化基板时,FRAMM阵列也为快速生物传感提供了令人兴奋的可能性。这个平台可能会对广泛的生物分子相互作用进行监测,而这些特征是无法用现有的检测技术来实现的。
基于FRAMM的生物传感技术理论背景
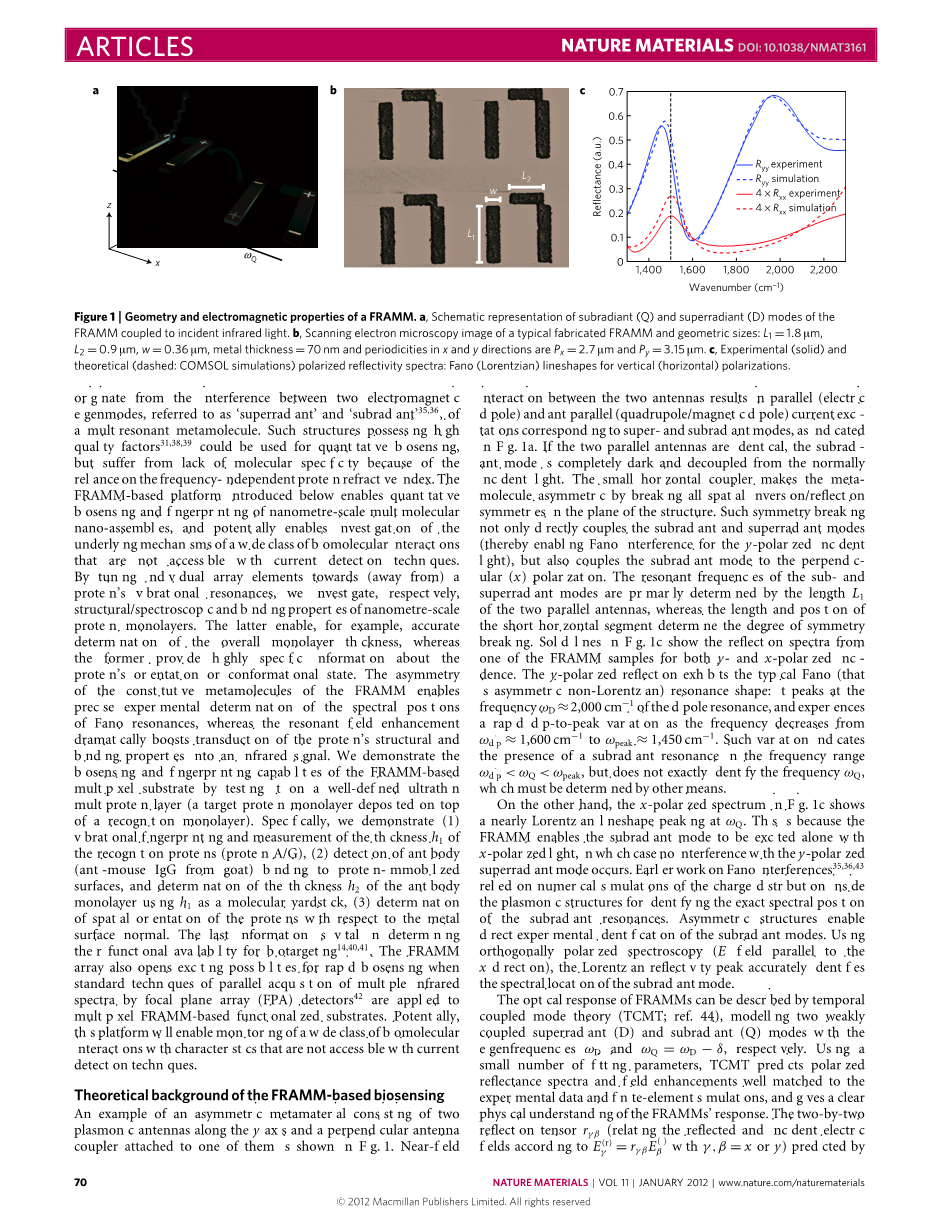
非对称超材料有两个等离子体沿着y轴,一个垂直天线耦合器和他们中的一个连接在一起,有一个这样的例子如图1所示:
图1
两个天线之间的近场相互作用是平行的(电的偶极子)和反平行(四极/磁偶极子)电流激发态与超-和子波的模式相对应,如图1a所示。如果两个平行的天线是相同的,那么子波的模式是完全黑暗的并且与正常的入射光无关。小水平耦合器通过打破所有空间的不变化/反射,使meta-分子不对称。结构平面上的对称性。这种对称破坏不仅仅是直接的结合子辐射和超辐射模式(从而允许法诺干扰y偏振方向的光),同时也将子波的模式与垂直(x)偏振相结合。子辐射和超辐射模式的共振频率也主要由两根平行天线的长度决定,然而长度和短的平行部分的位置决定了对称破坏的程度。图1 c中的实线显示了从一个同时包括x和y偏振方向的FRAMM样本而来的反射光谱。y偏振反射显示了典型的法诺(非对称的非洛伦兹)共振形状:它的顶峰在频率为的偶极共振,并且随着频率从到的降低,经历了一个快速的从高峰到峰值的变化这样的变化表明在频率范围内出现了一个次子的共振倾斜峰值,但不能精确地确定频率,这必须由其他方式来决定。
另一方面,图1 c的x偏振光谱显示了接近洛伦兹线型在上的峰值。这是因为FRAMM使子波的模式能够沿着x偏振光的方向传播,在这种情况下,不会干扰y偏振方向的超辐射模式。早期对Fano干扰的研究是基于对等离子体结构中电荷分布的数值模拟,以确定子系谐振的确切光谱位置。非对称结构能直接对子位模式进行实验验证。利用正交偏振光谱学(E场平行于x方向),洛伦兹的反射率峰值准确地识别出了子辐射模式的光谱位置。
FRAMM的光学响应可以用来描述耦合模式理论(TCMT),模拟两个弱项耦合超辐射(D)和子辐射(Q)模式特征频率和。使用一个少量的拟合参数,TCMT预测极化反射光谱和场增强与实验数据和有限元模拟,并给出了一个明确的结论对FRAMMX响应的物理解释。2*2的反射张量(和反射与电场相关,根据:和)为了FRAMM被TCMT预测可以被估测为:
(1)
在式中,和是两个光偏振方向上的耦合的超辐射和子辐射的效率。是在两个共振之间的弱近场耦合速率,由于短水平的天线和是固有的响应模式的生命长度。根据公式(1)偏振反射率有着fano或者洛伦兹线型,因为这些模式的不同的生命长度和他们的x轴和y轴的不同耦合效率。
根据TCMT,生命长度和依靠偏振辐射耦合效率的不同在FRAMMrsquo;s的表面取决于近场增强,这对于等离子体振子提高传感技术是十分重要的。特别地,它可以场强度根据子辐射(Fano)y偏振强度和超辐射模式和他们的生命长度,其中是质量因子(对于图1中的结构,)。使用Fano共振的激发x极化辐射会产生更小的场增强。。这些分析预测使用COMSOL模拟证实了TCMT在图2a,b,框架周围的近场增强是为激发框架的三种可能性而计算的共振:(1/3)窄带的Fano共振由y/x极化辐射激发,(2)宽带超辐射共振兴奋的y偏振辐射。只有情况(1)与Fano干扰相对应,会导致近场的大规模选择性增强,并为传感应用提供了保证,如下所示:
图2
蛋白质单分子的检测和表征FRAMMs的实现是通过测量在空白和功能化基质之间的反射率,。蛋白质单分子的存在厚度h改变了FRAMM的介电环境导致了频移:
(2)
其中是Q(D)模式的近场,e是蛋白质的电容率张量。复值影响光谱位置(指数诱发的位移)和寿命(表面增强的吸收)FRAMM的共振。那修改后的反射率张量,在功能化的FRAMM中从方程(1)中得到用代替,导致变化,,如图2 c,d所示。
因为电场对金属来说是正常的表面,从方程(2),根据计算出的频移h。这里我们假设模式的表面平均长度lgt;gt;h.根据数值模拟, ~50 nm是子模式。与方向相关的介电常数,,是假设是由一个多共振系列近似的:
(3)
图3
在这之中总和除以所有不活跃的振动模式用自然频率,阻尼率为和偶极子优势,和是非特异性的折射指数。表面选择规则改变了偶极子力量:根据平均方向关于金属表面的m振动模式常规的n-结构-解析生物传感是通过一组框架的像素点,它们都是光谱调优的各种振动共振(光谱分析生物分子的构象状态和方向)或者原理他们(使用纳米层厚度的测定非特异性)。
对蛋白质单分子的指纹和表征
几个黄金FRAMMs是在石英上制作的底物,如图1b所示,具有反射率谱用傅里叶变换红外(FTIR)显微镜测量(见方法)。1亿5千万的帧数像素被设计成在不同频率上产生共振,均匀扩展他们的尺寸。测量反射率光谱从图1c中所示的典型像素中,用于确定Fano共振频率q来自的峰值,并且是精确地安装数字(COMSOL)和分析(TCMT)计算。具体结构的生物传感是由在框架的表面固定两种蛋白质纳米分子:(1)一种单一的识别蛋白质A/G厚度h1,和(2)一个多蛋白的厚度H=h1 h2单层的山羊抗体IgG,在上面的图3b中显示的蛋白质A/G。光传导对黄金的蛋白质结合是通过测量标准化的差分反射率每个帧的像素都是由它的标记的。
为了说明结构特异性生物传感的概念,我们注意光谱最大值D(omega;Q)equiv;D(omega;Q)(omega;=omega;Q)取决于和之间的频率不匹配蛋白质的振动模式(例如,酰胺i/ii)就像这个特殊的(一个未知)属性模式:它们的偶极子优势、寿命和键合方向。蛋白质和FRAMM之间最强烈的相互作用对应于最大的发生在频率和框架的生命周期()与那些()重合分子的振动模式之一。虽然最终的匹配超出了这个工作的范围,频率与(绿线)的匹配产生最大的在图3a中所示的三个FRAMM中。然而,如果Fano共振从酰胺振动中分离出来是,然后是的值产生了非特异性蛋白质的厚度h。通过比较理论通过实验得到的不同光谱,我们发现通过椭圆光度法获得h1=2.7 nm,与h1=2.8 nm有很好的一致性。蛋白质A/G单层细胞发生变化可轻易检测到的反射率(参见图2d 和图3 a.c中的蓝/红光谱图),表明分子单层厚度可以可靠地测量准确性。
图4
类似地,IgG抗体单分子对通过测量蛋白质固定化的框架来检测(实线)产生的蛋白质双层的光谱厚度为(椭圆度值)并将其与(虚线)在图3 c中进行比较。两层的整体厚度明显地显现出来在峰值反射率比在图3 c中的三个FRAMM。预期的满足为FRAMM提供了一个准确的信息使用IgG单层膜厚度h1的测量作为一个分子标准。通过对比实验分析模型的数据估计,或H=7.8nm和h2= 5.1nm。对于抗体,h2是间接的信息关于他们在地表的方位和抗原绑定的可用性。具体来说,h2是一个较低的IgG层的实际高度(它有一个高的空分数由于其多碎片结构)。因为它的IgG高度只有4nm,我们可以得出结论:IgGs是主要面向端点的。
展望
FRAMM的概念使等离子体基板能够结合强大的近场增强,尖锐的光谱特征和通过极化反射光谱的共振频率的识别。设计用于在电磁波谱的中红外部分进行操作,可用于实现结构解决无标签的生物传感。摘要通过对指纹光谱区域中很大一部分的窄带框架像素的红外光谱,可以实现对生物传感的灵敏度、速度和时间分辨率的极大提高。通过利用红外透明的底物,我们可以想象在它们的自然水环境中,生物分子的构象动力学的奥秘,它们负责维持生命的分子结合过程。
方法
制造超材料的等离子体基板。多个1.5亿5千万米的像素,具有不同的天线尺寸使用电子束光刻技术,一个0.5毫米厚的石英衬底。聚甲基丙烯酸酯(950 PMMA C2)以1700转/秒的速度在底物上旋转30秒。铬的薄层(5nm)沉积在聚甲基丙烯酸甲酯促进导电。这一层被刻蚀了在接触后使用化学腐蚀剂(1020 AC),在开发样品。所需要的结构(剂量是 在10 pA的电流)使用Raith 50电子束光刻系统,然后在1:3 MIBK:IPA开发人员(MicroChem)中开发40秒。然后,一层80纳米厚的黄金被放置在一个热蒸发器上基本压力是torr。一层薄薄的(3 nm)的铬被用于提高金层对石英的附着力。最后,样本被浸没了在丙酮中大约有一个小时的时间。
单层化学和准备。蛋白质A/G和蛋白质A/G IgG薄膜附着在我们的金(Au)纳米粒子的表面上。在蛋白质固定之前,纳米颗粒基质被一种食人鱼清洗干净。溶液(H2SO4:H2O2=3:1)然后在去离子水里冲洗,以去除任何有机表面污染。蛋白质A/G浓度为IgG,IgG(在的PBS中汇集)被发现在底物表面孵化为1 h,进行了一次孵化后的清洗,以去除未装订的东西。蛋白质。形成A/G和IgG的蛋白质双层,IgG(来自山羊的抗体)随后被发现(在PBS中浓度为)纳米粒子,再一次孵化为1 h
全文共6239字,剩余内容已隐藏,支付完成后下载完整资料

英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[8960],资料为PDF文档或Word文档,PDF文档可免费转换为Word


