
英语原文共 9 页,剩余内容已隐藏,支付完成后下载完整资料
一种两亲性硅氧烷共聚物的制备方法及其对表皮成纤维细胞作用的研究
摘要:
本文介绍了聚二甲基硅氧烷-聚乙二醇(PDMS-PEG)ABA型线性块状低聚物对人类皮肤成纤维细胞增殖的影响。根据PDMS和PEG两种单元分子量和尺寸的差异,已被检测到的这种低聚物的分子量可从1335到5208不等,且亲水亲油平衡值(HLB)可从5.9到16.6变化不等。总体而言,研究表明低分子量或具有中等亲水性的共聚物能明显地减少成纤维细胞的增殖。在浓度为0.1和1.0wt%的低聚物中,成纤维细胞增殖和HLB/MW的比率之间存在反向线性关系。这有利于确定最高效结构的构建。这些结论证明PEG-PDMS-PEG块状共聚物有可能替代有机硅凝胶来修复增生性瘢痕。
关键词:表皮成纤维细胞,硅酮,硅氧烷低聚物,增生,两亲性
引言
聚二甲基硅氧烷(PDMS)和聚乙二醇(PEG)是两种使用得最广泛的聚合物生物材料,其使用可追溯到上个世纪中期。这两种聚合物都具有良好的生物相容性并且在药物输送、医疗器械和细胞培养器具等领域都有广泛的运用。虽然并不常见,但这些著名的聚合物也会产生一些负面作用。这些负面影响包括免疫系统对PEG的反馈、硅油产生的细胞毒性反应和与硅橡胶植入物相关的成纤维细胞囊泡的形成。PDMS硅树脂具有特殊的疏水性,但将其通过亲水性的PEG改性后,就能形成具有两亲性的非离子型表面活性结构。这种结构像微胶粒和小囊泡一样可以分散到水中,并且在化妆业和工业中都有重要的应用,也有作为药物输送物的潜力。
尽管PEG和PDMS共聚物已在传统行业中有所运用,近期在实验中发现,某种梳形PDMS-PEG共聚物会对表皮成纤维细胞和角质细胞产生影响,减少其增殖、活性和成纤维细胞胶原蛋白合成等。这种影响在很大程度上与分子量相关:经研究发现,在使用制备尺寸排除色谱法分离的不同共聚物片段中低分子量的片段对两种细胞的影响最大。并非仅仅PDMS-PEG共聚物一种非离子型两性共聚物可能会对细胞产生负面影响。例如,聚己酸内酯-PEG会对源自人类结肠癌的细胞表现出毒性,然而,用作哺乳动物细胞悬浮培养保护剂的聚环氧乙烷和聚环氧丙烷的共聚物(Pluronics)已证明会与细胞质膜相互作用并影响细胞表型。
两性共聚物与成纤维细胞的相互作用可能在医疗上有运用价值。比如,现已经发现常用于覆盖肥大瘢痕以减少红斑的硅凝膜薄片(SGS)会释放微量羟基官能化低分子硅油,而这种硅油可能会对运动机制产生巨大的影响。这个现象意义非凡,因为SGS的运动机制曾经被广泛认为是通过调节瘢痕组织水合作用来实现的,也就是说,这是一种被动的而非主动的疗法。
此结论来源于这些数据信息:低分子量的端羟基线性低聚物能以接近于疏水性小分子的速度(2.5times;109cm2s-1)渗过角质层。这些包括对梳形共聚物的检测等的研究证明PDMS-PEG有作为一种瘢痕治疗药物的潜力,并且可作为SGS的一种替代物或给其他的常用疗法提供一种其他的药物选择。比如,作为5-FU抗增殖剂或博来霉素的注射剂、某种细胞活素类疗法、额外的细胞基质调节剂或生长因子。
本研究检测了ABA型PDMS-PEG块状共聚物能否产生和之前研究过的低分子量梳形共聚物相同的效果。本团队合成一系列具有不同的PDMS和PEG重复单元数的共聚物并放置于人类表皮成纤维细胞上以研究这种低聚物的结构和性质与成纤维细胞增殖之间的关系。
方法
PDMS-PEG低聚物
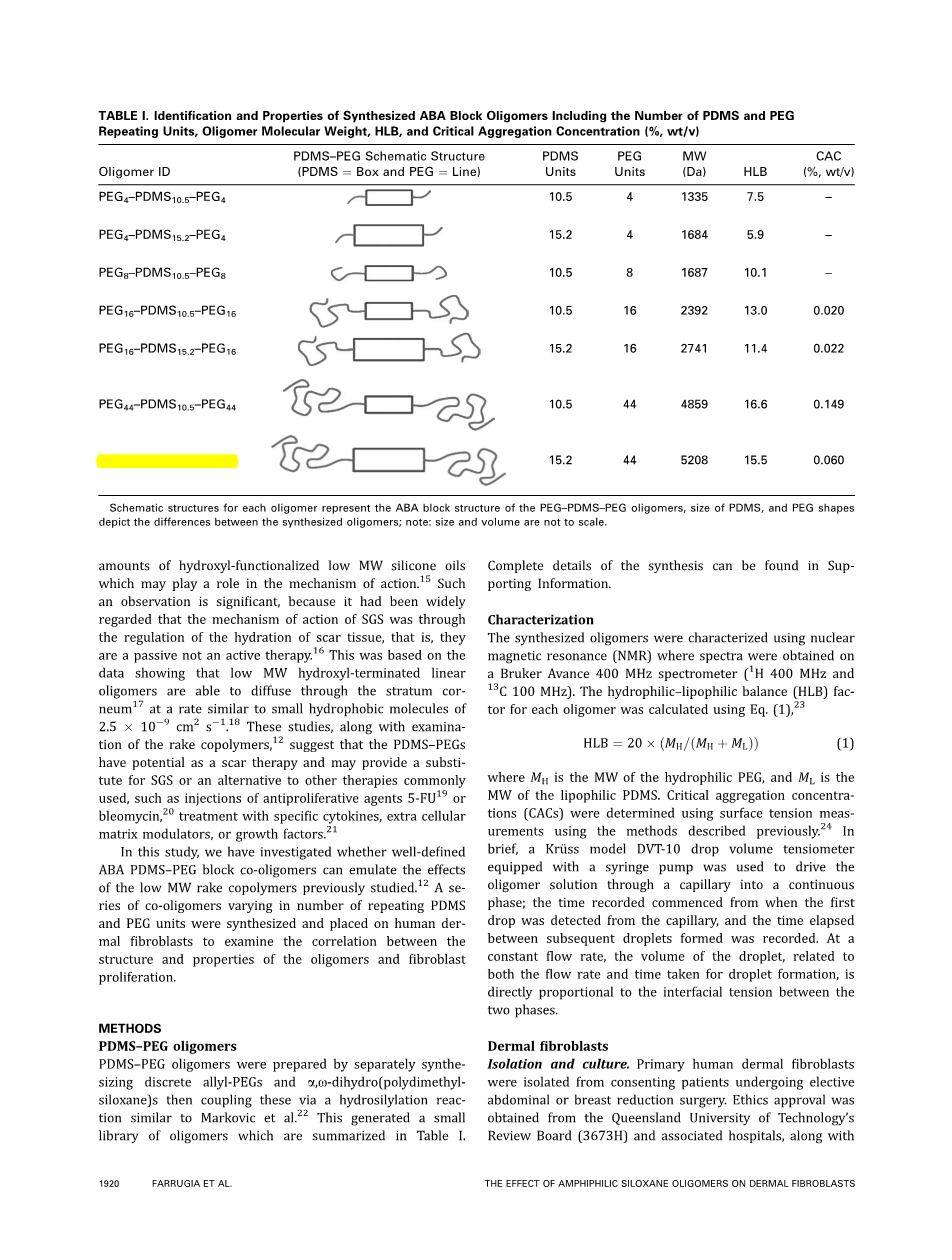
先分别合成一系列不同的丙烯基聚乙二醇和alpha;、omega;-二羟基(聚二甲硅氧烷),再将其通过氢化硅烷化反应共聚得到PDMS-PEG低聚物。这与MArkovic等人的实验方法相同。从中可得到了一系列低聚物。现将其资料归纳在表一中,其中提供了全部的合成细节。
表征方法
可将人造低聚物通过从Bruker Avance 400 MHz 波谱仪得到的核磁共振谱来鉴定。每种低聚物的亲水亲油平衡值(HLB)可通过式1计算出来:HLB=20times;(M1/(MH ML))式中MH是亲水性PEG的分子量,ML是亲油性PDMS的分子量。可用测量表面张力的方法提前测出临界聚集浓度(CASs)。简而言之,可以使用一台配备注射泵的Kruss式DVT10液滴体积张力计来将此低聚物溶液通过一根毛细管输送到连续相中;当观察到第一滴液滴从毛细管中落下时开始计时,记录到形成下一滴液滴所消耗的时间。在恒定流速下,小水滴的体积与流量和水滴形成用的时间有关,且与两相间的界面张力直接成比例。
表皮成纤维细胞
分离和培养
在经过病人的同意后,通过选择性腹胸缩小手术收集原生人类表皮成纤维细胞。本研究通过了昆士兰大学技术审查委员会的伦理审批,并且在执行手术前也获得了病人们的知情同意。另外,本研究严格按照赫尔辛基宣言的要求执行。
在37℃下将表皮切片粉碎并在0.05%胶原酶溶液(Gibco)中分解一晚。分解完成后,将悬浮液在400times;g下离心10分钟。再去除液面漂浮物并使得到的细胞颗粒悬浮于瓶中。再将其转移到组织培养瓶中。将成纤维细胞培养在高葡萄糖的达尔伯克改良尹格尔培养基(DMEM)(invitrogen)中,并补充胎牛血清(10%,FCS,Hyclone),盘尼西林,链霉素和L-谷氨酰胺(all invitrogen)。在37℃下,将成纤维细胞保存在一个潮湿的环境中(5%CO2),并每隔3到5天更换培养基。在本文前(p4-9)中能找到在试验中如何检测成纤维细胞的相关信息。
成纤维细胞增殖
在将用硅氧化低聚物处理成纤维细胞之前,在室温或37℃下,应将1%溶解度的低聚物溶液在培养基中检测3天。其中一种低聚物,PEG8-PDMS15.2-PEG8,因其不溶性,被排除在成纤维细胞增殖实验之外。
为了检测不同浓度对成纤维细胞增殖的影响,分别在细胞培养基中加入1,0.1,0.01和0.001%(w/v)浓度的实验低聚物溶液。将成纤维细胞植入96孔板(3times;103细胞/孔)中,并培养24小时使细胞黏附到孔表面。在培养结束后,将培养基吸出,用适量的实验溶液替换。试验中需确保成纤维细胞仅与细胞培养基接触。然后,成纤维细胞分别在与实验溶液和对照溶液接触的条件下在培养48小时。本研究使用CyQUANT细胞增殖化验盒(invitrogen)来鉴定细胞增殖情况。在增殖实验完成后,用PBS试剂冲洗细胞,并将其保存在-80℃条件下直到分析。在分析中,在CyQUANT试剂加入前将孔板用放射性示踪剂处理,且需检测到在480ex/520emnm的荧光。用实验溶液处理后的剩余细胞量和对照溶液处理后的剩余细胞量的比值来表示实验结果。另外为评估细胞增殖情况,需在24个孔板中拍下了细胞密度在2times;104细胞/孔板的成纤维细胞经低聚物处理后的代表图像,在经过低聚物和对照试剂处理后就可得到放大10倍后的成纤维细胞的代表图像。
数据分析
成纤维细胞增殖化验3次;在每次重复试验中,每个变量,低聚物和浓度,都设置3个平行实验。增殖数据表示为:平均数(标准化)plusmn;标准误差。成纤维细胞增殖数据由研究生进行t测试评估且以相关性p<0.005为合格标准。
结论
PDMS-PEG低聚物的合成
之前研究证明了市面上有售的由不同系列合成的PDMS-PEG梳形共聚物在实验中能减少表皮成纤维细胞增殖。随后,用尺寸排阻色谱法在实验指导下分馏共聚物混合物,证明其活性来源于一种平均含有7个二甲基硅氧烷主链单元且其中两个单元含有甲氮化PEG 350基团的低分子量化合物。为了验证ABA型块状PDMS-PEG共低聚物是否存在与之前在梳形混合共聚物中观察到的对成纤维细胞增殖相同的作用,合成了一系列类似的ABA型结构。这个小库中的分子都是由4种不同的allyl-PEG和两个不同分子量的端双氢PDMS通过氢化硅烷化反应合成的。除了PEG8-PDMS15.2-PEG8是完全不溶的且无法在本研究中进行进一步的测验,其他的所有共低聚物产物要么具有水溶性,要么可在水中分散。
以首先由Keegstra等人和Delamarche等人发表的方法为合成包含活性烯丙基末端的分离PEGs的基础。用市面上有售的相对应的单甲基醚通过烯丙基化合成含有不同聚合基团的allyl-PEGs。疏水性的alpha;、omega;-二羟基(聚二甲硅氧烷)主链由传统的二氟甲硫酸催化剂通过八甲基环四硅氧烷(D4)开环聚合合成,其中通过八甲基环四硅氧烷能使含氮硅氧烷端基功能化。本文用PEGm-PDMSn-PEGm来指代由氢硅氧末端硅氧烷和allyl-PEGs通过氢化硅烷化反应生成的一系列ABA型块状低聚物,其中n代表PDMS重复单元链长度,m代表PEG的链长度。需要注意的是,出于连贯性的考虑,在图一中,命名低聚物的脚注中n和m所指代的量不包括PEG和PDMS之间的重复单元。这种合成低聚物的整体结构如图1(B)所示。要注意的是,考虑到这些PEG-PDMS-PEG的低分子量,本文将其称为低聚物而不是聚合物,虽然出于简便的考虑,本文将这种硅氧化单元都命名为PDMS。相似的,四乙二醇和八乙二醇都称为PEGs。
在不同的浓度下,用表面张力的测量方式来得到CAC值(如图二所示,表一所归纳)。由PEG4或PDMS8合成的具有较高疏水性结构的低聚物在水中的溶解度是有限的。因此,无法测出它们的CACs值。通过NMR波谱和Eq(1)分别测出分子量和HLB值并将其总结在表一中。
PDMS-PEG的分子量和HLB值对表皮成纤维细胞增殖影响的实验
通过将分离下来的人类表皮成纤维细胞在其生长阶段与库中的人造PDMS-PEGs接触来检测PEG-PDMS-PEG对人类表皮成纤维细胞的作用。通过在不添加任何PDMS-PEGs的培养基中培养对照组的成纤维细胞来定义和标准化增殖的程度。图3显示了被低聚物处理后成纤维细胞的代表图像。在图3(B)中能清晰地看到与PEG4-PDMS10.5-PEG4接触的成纤维细胞形态上的断裂。从圆整和细胞膜上锯齿状边缘来看,细胞好像失去了其纤维状表面。因为四散分布的低聚物完全掩盖了图像,所以无法观察到暴露在PEG16-PDMS10.5-PEG16的细胞的图像。既然如此,在接触后,在加入新的培养基和即时拍照前,移除测试组的培养基并用PBS轻轻地清洗细胞以去除残留地低聚物。去除低聚物后地细胞图像显示(Fig3.(E2))该低聚物对细胞形态的改变与PEG4-PDMS10.5-PEG4的相似。和对照组相比较,余下的低聚物对细胞形态产生的影响很小,甚至没有影响。
图像也显示在细胞培养基中的低聚物的溶液特性。培养在含有最强的亲脂性组分的两种低聚物,即PEG4-PDMS10.5-PEG4(Fig.3(A))和PEG4-PDMS15.2-PEG4(Fig.3(B))中的成纤维细胞的图像看上去似乎很模糊。这是因为相分离出的低聚物无法聚焦,且离组织培养皿的表面较近。虽然在这种情况下会形成巨大的水泡,但同样的现象在PEG8-PDMS10.5-PEG8(Fig.3(C))和培养基之间还是很明显的。
将经过从0.001到1(w/v)不同浓度的细胞增殖程度与对照组相比较的,并归纳在表2中。此浓度范围能用来比较整个库中的PDMS-PEGs甚至在某种程度上比较剂量对成纤维细胞增殖的影响。对具有最长PEG基团的低聚物,即PEG44-PDMS10.5-PEG44和PEG44-PDMS15.2-PEG44来说,与对照组相比较,在该浓度范围内,未能检测到其能减少增殖。而被其他的各种1%(w/v)浓度的低聚物处理后会显著减少细胞增殖。经PEG4-PDMS10.5-PEG4(1%,w/v)和PEG16-PDMS10.5-PEG16(1%和0.1%,w/v)处理后,细胞增殖明显减少。然而,被整个浓度范围内的PEG8-PDMS10.5-PEG8处理后都会明显减少细胞增殖。这个结果也同样体现在如图3中所观察到的细胞数量的减少上。
通过作图,可看出低聚物对成纤维细胞增殖的影响与其分子量有关(Fig.4)。从(除了PEG4-PDMS10.5-PEG4)所测试的低聚物在最高浓度的数据可以看出这样一个趋势:用较低分子量的低聚物处理细胞会减少成纤维细胞增殖。当成纤维细胞暴露在分子量最低的低聚物PEG4-PDMS10.5-PEG4中时,其增殖减少的量最大。在这种情况下,其增殖减少了90%。相反,两种分子量最高的低聚物,PEG44-PDMS10.5-PEG44和PEG44-PDMS15.2-PEG44(分子量>4500Da),在最高的浓度下,其处理过的细胞的增殖也只减少了10%不到,且在整个测试浓度范围内其对增殖的影响几乎为零。
除了低聚物分子量的变化,改变PDMS和PEG的重复单元数也会改变低聚物的HLB值(Table1).在图5中,可看到以低聚物在各个浓度下的HLB值为应变量的相似的成纤维细胞增殖数据。在试验中,低聚物的HLB值的范围为5.9到16.6。从实验中的每一个低聚物浓度(1,0.1,0.01和0.001%,w/v)中,可以看出这样的一个趋势:当暴露在HLB值在中间范围(7.5-13.0)内的低聚物中时,成纤维细胞的增殖会减少。
在分别测验低聚物的分子量或HLB值的变化对成纤维细胞增殖的影响后,可将这两种参数转化为一个参数,100HLB/MW,如图6所示
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[137076],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 播撒生物炭促进鸟粪石形成,但加速重金属积累外文翻译资料
- 钢铁工业余热有机朗肯发电的能量及炯分析外文翻译资料
- 深度共晶溶剂微波辅助处理木质素-碳水化合物复合 物的高效裂解及超快提取木质素低聚物外文翻译资料
- 功能化杯状芳烃离子团族[4]的合成、晶体结构及竞争结合性能外文翻译资料
- 面向高能量密度柔性超级电容器的无纺布用黑磷杂化微纤维的微流控纺丝结构外文翻译资料
- 活性炭对水溶液中氨的吸附外文翻译资料
- 制备可控海胆状NiCo2S4微球协同硫掺杂石墨烯作为高性能 二次锌空气电池的双功能催化剂外文翻译资料
- 钛酸盐材料对重金属离子的吸附外文翻译资料
- CO2敏感催化剂的合成与表征温度响应催化聚离子液体微凝胶外文翻译资料
- 温度响应微凝胶薄膜在湿环境中作为可逆二氧化碳吸收剂外文翻译资料


