尖孢镰刀菌引起西葫芦枯萎病在韩国的首次报道
原文作者 In-Young Choi1, Ju-Hee Kim1, Wang-Hyu Lee2, Ji-Hyun Park3 and Hyeon-Dong Shin3,*
单位 1全罗北道农业研究与服务推广,2韩国全北国立大学农业生物学和植物医学中心,3高丽大学环境科学和生态工程部
摘要:2013年5月,在韩国全州市第一次发现了西葫芦枯萎病。症状包括叶片枯萎、老叶干燥、枯萎和植株发育不良。被感染的植株在生长中最终死亡。基于形态学特征和分子标记的系统发育分析(rDNA内部转录间隔区和翻译延长因子1alpha;),该致病真菌被确认为尖孢镰刀菌。通过人工接种证明分离的典型代表菌的致病性,这符合科赫式法则。据我们所知, 在韩国这是第一次报道尖孢镰刀菌引起西葫芦的枯萎病。
关键词:西葫芦;尖孢镰刀菌;枯萎病 ;致病性
西葫芦,属于葫芦科,一种夏南瓜,在许多国家作为蔬菜广泛种植。在韩国,为了满足国内消费,西葫芦的栽培面积大约为1400公顷。在世界范围内,已经有几种真菌被确认能够感染西葫芦,比如链格孢菌和瓜链格孢菌(链格孢属叶斑病)、瓜霜霉病(霜霉病)、白粉菌(白粉病)、刺盘孢菌(炭疽病)、黄瓜黑星病菌(痂或流胶病)、壳针孢属(壳针孢属叶斑病)、蔓枯病菌(蔓枯病)、壳球孢菌(木炭腐病)、腐霉菌(植物幼苗或插枝的腐烂)、丝核菌(植物幼苗或插枝的腐烂)、镰刀菌(植物幼苗或插枝的腐烂和枯萎病)[1]。其中,镰刀菌枯萎病对植株的寿命和产量都产生了重要的影响。镰刀菌枯萎病在世界各地内均有发生,并且镰刀菌被认为是植物枯萎、黄化和死亡的植物病原体[2]。
Mycobiology 2015 June, 43(2): 174-178 http://dx.doi.org/10.5941/MYCO.2015.43.2.174 pISSN1229-8093 bull; eISSN 2092-9323
copy; The Korean Society of Mycology *Corresponding author
E-mail: hdshin@korea.ac.kr
Received January 24, 2015 Revised May 4, 2015 Accepted June 11, 2015
这是一篇在知识共享非商业性许可证条款(http://creativecommons.org/licenses/by-nc/3.0/)下的可开放获取的文章。允许在任何媒介中无限制的非商业用途、分布、和复制,保证正确引用最初的工作。
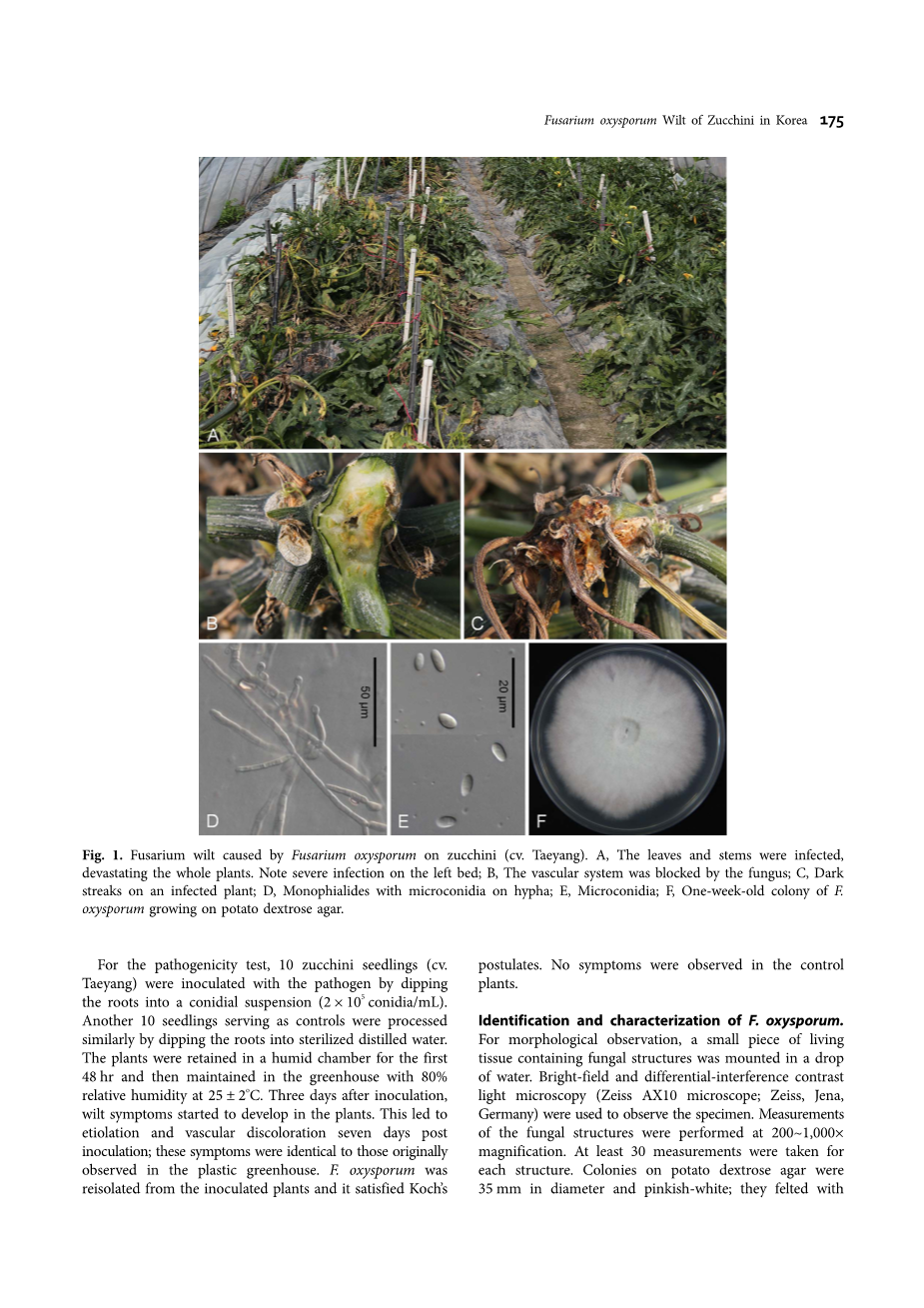
2013年5月,在韩国全州市的一项调查中,在多种塑料温室大棚里,有成百的西葫芦植株被未知的真菌感染,出现枯萎症状,病害发生率为15~35%(占所感染植株的百分比)。其最初症状表现为,在四月时出现叶片萎黄病,受感染植株的直立挺拔能力逐步减弱、枯萎,最终在六月初死亡,从而造成严重的经济损失(图1A)。据种植户所说,枯萎病在每年的炎热天气时发生。因为感染后会阻塞植株的维管系统,从而干扰水分的运输,使叶片从浅绿色变成黄色,并且抑制根的生长。受感染的茎坏死,并且在维管组织内部产生污点。植株主冠的维管内部和表皮组织产生褐色到黄褐色的污点(图 1B 和图1C)。
真菌的分离和致病性测定。 取受感染的西葫芦植株,在茎上的不同区域剪下发生典型的镰刀菌枯萎病部分,作为植物样本。受感染组织表面用1% NaOCl溶液进行消毒1分钟,再用无菌蒸馏水清洗2-3次。干燥后,植入到90-mm的马铃薯葡萄糖琼脂培养基(Difco,Sparks,医学博士,美国)培养皿中,25℃、黑暗条件下培养1星期。菌株的凭证标本保存在韩国高丽大学植物标本馆(KUS)。从受感染的维管组织中获得三个分离株。取其中一株有代表性的分离株放置于韩国农业菌种保藏库(登录号:No. KACC47262),并用于致病性实验和分子分析。
图1. 西葫芦枯萎病由尖孢镰刀菌引起。A. 叶和茎被感染,整个植株被破坏。记录左边的严重感染株;
B. 维管系统被真菌阻塞;C.受感染的植物上的暗条纹;D. 菌丝上带有小分生孢子的单瓶梗;E,小分生孢子;F. 马铃薯葡萄糖琼脂培养基培养一周的菌落。
进行致病性测定时,取10株西葫芦幼苗,将幼苗的根在真菌分生孢子悬浮液(2 times; 105 个孢子/毫升)中蘸一下,将病原体接种到植株上。另取10株西葫芦幼苗作为对照组,将根在无菌蒸馏水中蘸一下。先将幼苗植株置于潮湿的室内48小时,再置于25 plusmn; 2℃、相对湿度为80%的温室中。接种三天后,枯萎症状开始在植株上形成。接种七天后出现黄化现象,维管组织产生污点。这些症状与最初在塑料温室中观察到的症状相同。再从接种的受感染植株上再次分离到尖孢镰刀菌,满足柯赫氏法则。然而在对照组植株上未发现任何症状。
尖孢镰刀菌的鉴定与特征识别。 形态学观察时,一滴水中的一小片真菌活体组织中就包含了真菌的结构。使用明视野和微分干涉对比光学显微镜(AX10蔡司显微镜; 蔡司, 德国耶拿)观察样本。真菌结构大小采用在200-1000times;放大倍率下的测量值,每一结构的测量值至少为30。图1F 中,PDA培养基上的菌落直径为35mm,略带桃色;菌落在一周内与棉絮状的气生菌丝粘合。培养时,单瓶梗上形成丰富的小分生孢子,同时在淡橙色的分生孢子座上形成镰刀状的大分生孢子(通常很丰富)。大分生孢子长度短,镰刀状几乎成直线,薄壁,通常有三个隔膜。通常在菌丝短状单瓶梗的假头上形成丰富的透明、光滑、椭圆形、无隔膜或一个隔膜或罕见的两个隔膜的小分生孢子,隔膜有轻微收缩,大小在4-11 times; 2.5-5.0 mu;m范围内(图1D 和图 1E)。根据形态学特征和培养特性,将该菌鉴定为尖孢镰刀菌E. F. Sm.amp; Swingle[3]。
基因的DNA序列差异以往被用于支持验证镰刀菌种的形态学鉴定。此外,DNA 序列的系统发育分析已被成功地用于识别与评价密切相关的镰刀菌间的遗传关系。翻译延长因子1alpha;基因(TEF)的DNA序列已经被广泛地应用于镰刀菌的鉴定[4]。为了进一步确认基于形态学特征的初步鉴定,使用试剂盒(Qiagen Inc.,Valencia,美国加利福尼亚州)提取真菌的DNA。完整的核糖体内部转录间隔区(ITS)和TEF的部分序列分别用引物ITS1/ITS4[5] 和EF-1/EF-2[6]进行扩增。通过1.5%琼脂糖凝胶电泳分离扩增子,然后利用PCR提纯设备(Core-one;Core-Bio,韩国首尔)进行提纯。使用BigDye终止循环测序试剂盒(应用生物系统公司,美国加利福尼亚州福斯特城)反应,进行测序。利用ABI 3130自动DNA测序仪(应用生物系统公司)进行分析。通过分别将菌株的ITS和TEF序列在GenBank数据库(国家生物技术信息中心(NCBI)美国国家健康研究所,贝塞斯达,医学博士,美国;http://www.ncbi.nlm.nih.gov/BLAST)和FUSARIUM ID (http://isolate.fusariumdb.org/blast.php)中进行比较,确定分离的菌株的鉴定。ITS系统发育分析和TEF通过使用MEGA 6.0[7]邻接法进行,并根据Tamura-Nei参数模型计算序列距离。炭疽病菌(DQ084495)用作系统发育分析的外群。进行1000次重复的引导分析,以确定每个进化枝的比例支持。具有代表性的菌株的ITS序列和TEF序列在GenBank数据库中的登录号为KF372590 (535 bp) 和 KF372592 (679 bp)。在GenBank数据库中进行ITS序列的BALST同源检索,检索产生同一性为100%的尖孢镰刀菌(KC577181)的核苷酸序列;在FUSARIUM ID[6]中,TEF序列检索结果也完全相同(FD-01376)。使用邻接法生成的系统发育树分组生成处于同一进化枝的三个西葫芦分离物,包括JABRA2和JABRA3(图2和图3)。
图2. 系统发育分析通过邻接法比较从GenBank数据库中获得的尖孢镰刀菌核糖体DNA内部转录间隔区序列和其他镰刀菌的ITS序列。分支上面的数字表示自举值。本研究中的真菌菌株用粗体显示。
图3. 系统发育分析通过邻接法比较从GenBank数据库中获得的尖孢镰刀菌转录延长因子1alpha; DNA序列和其他镰刀菌的TEF序列。分支上面的数字表示自举值。本研究中的真菌菌株用粗体显示。
在全世界已经报道过尖孢镰刀菌诱导西葫芦的枯萎病,比如在墨西哥、波兰和希腊[1]。虽然在韩国以前有过尖孢镰刀菌在南瓜属上的记录,但是该记录很模糊而且需要验证[8]。据我们所知,这是在韩国的首次报道,尖孢镰刀菌能引起西葫芦枯萎病。因为西葫芦是非常重要的经济作物,我们的研究结果强调了疾病管理的必要性。在韩国的温室塑料大棚中,西葫芦通常在土壤中重复种植。这一做法是这些病原体相对快速传播的潜在原因。病原体也可以通过感染杂草进行传播或在腐烂的植物上形成腐生性营养的菌丝和厚垣孢子,生存在土壤中 [9]。目前,防治西葫芦枯萎病的最佳控制策略是轮作和土壤消毒。细心的滴灌管理也是重要的大棚管理方式。因此,目前迫切需要制定化学和生态友好型的控制方式,来减少这些病原真菌造成的农作物经济损失。
致谢
本项研究是由韩国农业发展处的农业科学和技术发展合作研究计划支持(项目编号PJ0108252015)。
参考文献
1. Farr DF, Rossman AY. Fungal Databases. Bushland: Systematic Mycology and Microbiology Laboratory, Agricultural Research Service, US Department of Agriculture; [cited 2015 Mar 1]. Available from: http://nt.ars-grin.gov/fungaldatabases/.
2. Lee YS, Park CS. Fusarium species of Korea. Plant pathogens of Korea No. 5. Suwon: National Institute of Agricultural Science and Technology; 2001.
3. Nelson PE, Toussoun TA, Marasas WF. Fusarium species: an illustrated manual for identification. University Park: Pennsylvania State University Press; 1983. p. 142-5.
4. Hsuan HM, Salleh B, Zakaria L. Molecular identification of Fusarium species in Gibberella fujikuroi species complex from rice, sugarcane and maize from peninsular Malaysia. Int J Mol Sci 2011;12:6722-32.
5. White TJ, Bruns T, Lee S, Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis MA, Gelfand DH, Sninski JJ, White TJ, editors. PCR protocols: a guide to methods and applications. San Diego: Academic Press; 1990. p. 315-22.
6. Geiser DM, del Mar Jimenez-Gasco M, Kang S, Makalowska I, Veeraraghavan N, Ward TJ, Zhang N, Kuldau GA, Orsquo;Donnell K. FUSARIUM-ID v. 1.0: a DNA sequence database for identifying Fusarium. Eur J Plant Pathol 2004;110:473-9.
7.Tamura K, Stecher G, Peterson D, Filipski A, Kumar
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 5 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[286465],资料为PDF文档或Word文档,PDF文档可免费转换为Word


