
英语原文共 8 页,剩余内容已隐藏,支付完成后下载完整资料
液液相分离在细菌RNA代谢中的作用
虽然细菌通常缺乏膜结合细胞器,但亚细胞组织的机制尚不清楚。细菌最近被发现含有许多生化途径的酶的无膜细胞器。这些细胞器,称为生物分子凝聚体,已被发现通常通过液-液相分离过程形成,并且通常富含核酸结合蛋白。有趣的是,真核生物和细菌转录和RNA衰变机制被发现形成生物分子凝聚体。此外,来自真核生物和细菌的DEAD boxATP酶也被发现调节生物分子凝聚。RNA代谢酶在跨结构域组装成生物分子凝聚体的共同能力表明,这种亚细胞组织模式有助于控制RNA代谢。
地址
韦恩州立大学生物科学系,底特律,MI,48202,美国
相应作者:Schrader,JaredM(Schrader@wayne.edu)
Current Opinion in Microbiology 2021, 60:91–98
这篇综述来自一个关于细胞调节的主题问题
导言
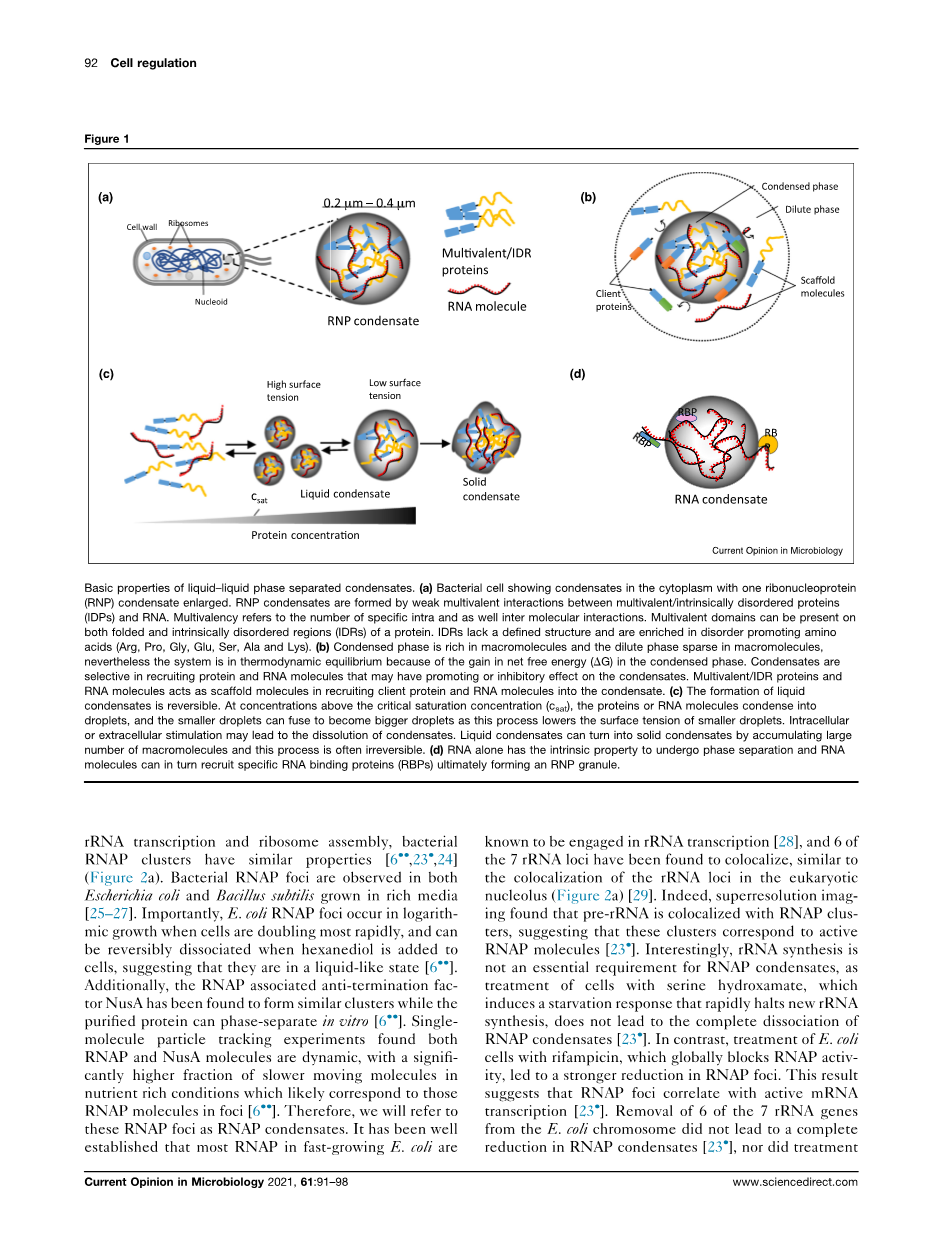
虽然真核细胞通过膜结合细胞器组织其生化途径,但最近对无膜细胞器的研究揭示了它们的关键和广泛的作用。这一点是由发现,这些无膜细胞器通常可以形成液-液相分离(LLPS),这允许内部生化活性。这一过程形成的无膜细胞器通常被称为生物分子凝聚物(以下简称凝聚物),包括核仁、卡哈尔体、加工体(P-体)和应力颗粒等。在细菌细胞中也发现了类似的凝聚体(图la),而且由于普遍缺乏膜结合细胞器,已被认为在组织细菌细胞质中起着关键作用。有趣的是,转录机制和RNA衰变机制被发现在真核生物和细菌中形成凝聚体。本综述将重点介绍凝聚体中细菌RNA代谢的最新进展,然后将与功能相关的真核凝聚体进行比较。
真核P颗粒表现为液体的最初发现在许多真核无膜细胞器中引发了类似的发现。体内和体外研究的结合表明,蛋白质和RNA通过形成由能量有利的过程驱动的瞬态和多价弱分子间相互作用而经历LLPS,从而形成凝聚相(大分子丰富)和稀相(大分子稀疏)(图lb)。最大的一类缩合物,核糖核蛋白(RNP)缩合物,由于其在组织RNA转录、剪接、RNA修饰、定位、翻译和衰变]中的关键作用,正引起人们的极大兴趣。凝结剂通过客户端分子的选择性通透性、提高底物浓度和[15]化学反应的调节来帮助RNA代谢。具有内在无序区(IDRs)的多价RNA结合蛋白(RBPs)是参与凝结形成[2]的关键支架蛋白。IDRs充当“间隔器为了提供灵活性,多价弱相互作用充当“贴纸”,以促进蛋白质之间的动态关联。这些相互作用可以发生在折叠结构域和IDR之间,其新的特异性规则由氨基酸含量决定。这些支架还可以通过蛋白质-蛋白质相互作用将客户蛋白(图1b)招募到凝结水中,从而带来新的生化功能。此外,在没有蛋白质的情况下,RNA通过分子间碱基对形成缩合物,这可能招募特定的RBPs(图1d)。总之,通过相分离组装无膜细胞器的能力可能在组织细菌细胞质内的生化过程中发挥关键作用。
作为rRNA转录的组织者,RNAP凝聚
真核生物RNA聚合酶(RNAPs)I和II和细菌RNAP形成凝聚物。由于已知RNAPI定位于核仁(组织rRNA转录和核糖体组装的最具特征的真核浓缩物之一),细菌RNAP簇具有相似的性质(图2a)。在大肠杆菌和枯草芽孢杆菌中均观察到细菌RNAP病灶。重要的是,大肠杆菌RNAP焦点在细胞快速翻倍时发生对数生长,当六烯二醇添加到细胞中时可以可逆地分离,表明它们处于液体样状态。此外,RNAP相关的抗终止因子NusA已被发现形成类似的簇,而纯化的蛋白质可以在体外相分离。单分子粒子跟踪实验发现,RNAP和NusA分子都是动态的,在营养丰富的条件下,较慢的运动分子的比例要高得多,这可能与焦点中的RNAP分子相对应。因此,我们将这些RNAP焦点称为RNAP凝聚。
目前已证实,在快速生长的大肠杆菌中,大多数RNAP是已知参与rRNA转录,7个rRNA位点中有6个被发现共定位,类似于真核核核仁中rRNA位点的共定位(图2a)。事实上,超分辨率成像发现预RRNA与RNAP簇共定位,表明这些簇对应于活性RNAP分子。有趣的是,rRNA的合成并不是RNAP凝聚物的基本要求,因为用丝氨酸羟甲酸酯处理细胞,从而引起饥饿反应,迅速停止新的rRNA合成,并不会导致RNAP凝聚物的完全解离。相反,用利福素治疗在全球抑制RNAP活性的大肠杆菌细胞,导致RNAP病灶显著降低。这一结果表明RNAP病灶与活性mRNA转录相关。从大肠杆菌染色体中去除7个rRNA基因中的6个并不会导致RNAP凝聚物的完全减少,也没有使用DNA陀螺仪酶抑制剂或类核相关蛋白基因fis或lrp的缺失,这表明仅类核结构并不能导致RNAP冷凝物的形成。
液液相分离冷凝物的基本性质:
(a)显示细胞质中凝结的细菌细胞,其中一种核糖核蛋白(RNP)凝结物扩大。RNP凝聚物是由多价/蛋白质紊乱蛋白(IDP)和RNA之间弱的多价相互作用形成的。多重性是指特定的内部和分子间相互作用的数量。蛋白质的折叠区域和内在无序区域(IDRs)都可以存在多个结构域。IDRs缺乏明确的结构,并且富含促进氨基酸的紊乱(Arg、Pro、Gly、Glu、Ser、Ala和Lys)。
(b)凝聚相富含大分子,稀相在大分子中稀疏,然而,由于净自由能(DG)在凝聚相中的增益,系统处于热力学平衡状态。冷凝物在招募蛋白质和RNA分子时具有选择性,这些分子可能对冷凝物有促进或抑制作用。多重性/IDR蛋白和
RNA分子充当支架分子,将客户端蛋白质和RNA分子招募到凝结水中。
(c)液体冷凝物的形成是可逆的。在临界饱和浓度以上的浓度(c坐着蛋白质或RNA分子凝结成液滴,较小的液滴可以融合成较大的液滴,因为这一过程降低了较小液滴的表面张力。细胞内或细胞外刺激可能导致凝液溶解。液体凝结物可以通过积累大量的大分子而变成固体凝结物,这一过程往往是不可逆的。
(d)RNA本身具有进行相分离的内在特性,而RNA分子又可以招募特定的RNA结合蛋白(RBPs),最终形成RNP颗粒。
原核和真核RNP颗粒参与RNA合成和降解:
- 左:在真核生物中,核糖体RNA(rRNA)基因簇由RNA聚合酶l(RNAPI)转录,并在位于细胞核的称为核仁的液体凝结物中加工。处理后的18S和12SrRNA被输出到细胞质中,用于随后的核糖体组装和翻译。右:在大肠杆菌中,RNA聚合酶(RNAP)焦点与rRNA操纵子共定位(在大肠杆菌中,7个rRNA操纵子中的6个-rrnE、rrnG、rrnD、rrnA、rrnH和rrnB是共定位的)。细菌中rRNA操纵子和RNAP的这种排列模拟了真核生物中的核仁样分隔化,尽管细菌凝聚体中rRNA的转录和处理需要证明。
(b)真核生物(左)的加工体(P体)可与细菌(右)的细菌核糖核蛋白体(BR体)进行比较)。这些缩合物在功能等效蛋白质和RNA分子的存在或不存在方面有很多相似之处。虽然人们一致认为BR体主要作为RNA衰变室,但目前还没有共识P体是作为RNA衰变还是储存室。
而rRNA转录和rRNA基因拷贝数的减少导致RNAP凝结水的大小和数量的减少。进一步将需要研究,以确定精确的大分子规则,控制RNAP凝聚物的形成。此外,真核生物中的RNAPI负责rRNA转录,并主要存在在核核中,在核核中rRNA基因、处理因子和修饰酶共定位,以允许共转录rRNA处理。然而,目前尚不清楚加工因子和修饰酶是否也与细菌RNAP凝聚物共定位,以促进核糖体的共转录rRNA加工和组装。此外,真核生物RNAPII被发现组装成超增强子簇,刺激mRNA合成,并影响与剪接凝聚的协调。目前尚不清楚细菌RNAP凝聚是否影响mRNA转录。
RNA衰变机制凝聚刺激细菌的mRNA衰变
真核mRNA衰变机制已被鉴定为定位于细胞质凝集物,称为加工体(P-体)和应激颗粒(图2b)。虽然主要的细胞质核酸酶XRN1存在于P体和应激颗粒中,但细菌最常使用不同的mRNA衰变核酸酶,其中最常见的是RNaseE。从酵母到人类,P体和应激颗粒是保守的,由许多mRNA衰变相关的核酸酶、RNA伴侣和翻译抑制因子组成的凝聚体。在含有RNaseE基RNA降解小体(曲齿杆菌、新菌、农杆菌、大肠杆菌和蓝杆菌)的许多细菌物种中,RNA降解体是促进细菌中mRNA衰变的活性多蛋白复合物,已被发现形成细菌核糖核蛋白体(BR体),可作为细胞质灶。以RNase J为基础的降解体(幽门螺杆菌)和RNase Y为基础的降解体(B.枯草杆菌)。除了支架核酸酶,RNA伴侣和额外的RNase是BR体的com-mon组分。在的RNase E。枯草杆菌中的新月体、大肠杆菌和RNase Y都经历了病灶融合事件,提示了类似液体的行为。此外,发现新月体RNase E的IDR对细胞内的病灶形成是必要的和足够的,并且能够在体外相分离成液滴,这表明这种蛋白质特征控制了BR体的缩合。从E.大肠杆菌或大肠杆菌中删除C端IDR。新月体RNase E减缓了细胞中mRNA的衰变速度
大多数细菌通过内切核裂解引发细菌mRNA的衰变,然后是mRNA衰变中间体的35外核降解,因此在野生型细胞中几乎没有检测到mRNA衰变中间体。有趣的是,破坏与外切酶关联或缺乏C端IDR的RNaseE突变体显示mRNA衰变中间体的积累增加,这表明BR体有助于确保mRNA衰变片段在BR体内降解(图3)。
缩合物的一个基本特征是选择性渗透性。体丰富长时间翻译不良的mRNAs和小调节RNA(SRNAs),并排除结构RNA,包括rRNA和tRNA。另一个有趣的观察是物理排斥从细菌中的BR体和真核生物中的P体和应激颗粒中翻译核糖体(图2b)。这种现象具有从翻译过程划分mRNA衰变过程的作用。sRNA的富集暗示了转录后基因调控在BR体中的可能存在。沉默RNA也存在于真核RNP颗粒(P-体和应激颗粒)中,但对其功能知之甚少。细菌RNA伴侣蛋白Hfq介导sRNAs与mRNAs的相互作用,调节mRNAs的稳定性和翻译。在缺乏RNaseE-C端IDR的菌株中,SRNA诱导的mRNA衰变明显减少,SRNARNA共定位明显增加,提示BR体可能刺激沉默的mRNA的衰变。有趣的是,Hfq在氮饥饿时被发现形成细胞质灶然而,尚不清楚这些灶是否与BR体定位。
虽然还没有完整的BR体相关蛋白库存,但P体和应激颗粒已知含有>100个蛋白质。在P体中,一个子集的蛋白质存在于高浓度形成“核心”,而大多数P体蛋白存在于较低的化学计量。虽然假设RNA降解体形成BR体核心,但系统研究BR体相关蛋白将回答这一问题。需要研究的另一个问题是,细胞中的所有BR体是否都具有相同的客户端蛋白混合物,或者BR体是否含有基于mRNA特异性RNA加工/衰变因子要求的异质客户端组成。
此外,RNA似乎是组装新杆菌、农杆菌、大肠杆菌和大肠杆菌中RNaseE基灶的关键成分。大肠杆菌,它不需要在枯草杆菌中的RNaseY灶,表明不同物种的BR体的组装要求不同。叶绿体线粒体和RNA应激颗粒中D-Foci的存在表明,在这些内共生细胞器中使用了类似的组织机制。
DEAD box ATP酶作为细菌凝结物的调节剂?
DEAD box ATP酶属于解旋酶超级家族2,由两个(RecA样结构域)组成的保守解旋酶核心组成。名称“DEAD box”来源于保守的Asp-Glu-Ala-Asp的存在解旋酶核心结构域1中的氨基酸基序。DEAD box ATP酶通过ATP依赖的RNA结合和ATP水解改变RNA结构和重塑RNPs。最近对真核细胞的研究认为,死亡盒ATP酶在调节凝结物的形成和周转方面具有新的双重作用(图4).带有IDR的DEAD box蛋白可以经历LLPS,并促进RNP凝聚的形成,无论是自己的还是自己的在其他蛋白质伙伴的帮助下。此外,它们可以通过ATP结合或水解促进凝结水RNP组成的变化,从而调节凝结水的形成。大多数细菌都有参与RNA代谢的各种步骤的DEAD boxATP酶,其中一些细菌具有长IDRs或低复杂度结构域,具有形成凝聚体的倾向.例如,E。大肠杆菌有五个DEAD box蛋白,RhlB,RhlE,DeaD,锶B和DbpA,其功能参与核糖体生物发生、RNA周转和翻译起始等多个过程。其中三种(DeaD、SrmB和RhlE)具有较长的IDRs,在其生理浓度下或在体内过度表达时,在体外容易形成缩合物.虽然RhlB缺乏长的IDR,并且在体外不相分离,但它确实与RNaseE相关,并被招募到BR体中,尽管ATP酶活性在调节BR体中的作用尚未被研究.酵母Dhhl DEAD box ATP酶活性已被证明允许快速的室间周转和释放RNA,并且有可能RhlBATP酶活性在BR体中提供类似的功能。DEAD box ATP酶的活性也可能能够阻止BR-体固化,就像对真核RNP颗粒的观察一样,这可能使它们过渡到mRNA储存颗粒。未来研究的另一个重要目标将是确定含有IDRs的细菌Dead盒蛋白是否在体内形成独立的凝聚体。如果细菌能同时产生多个RNP凝聚,这将使细胞能够将独特的客户蛋白/RNA分子招募到每个凝结物中,并组织不同的RNA过程。
RNase E
RNA moleciile
Aconitase
DEAD box protein
RNase D
Polysomes
Transfer RNA
Small RNA
细菌核糖核蛋白体(BR体)中的RNA衰变)。
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[259050],资料为PDF文档或Word文档,PDF文档可免费转换为Word


