
英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
新生DNA甲基转移酶DNMT3A的缺失促进了肺癌细胞的恶性增殖。
摘要:DNA甲基化过程中的变异已经与全基因组低甲基化还有许多肿瘤中的区域重新甲基化相联系起来。重新甲基化是由重新甲基化的DNMT3A和DNMT3B这两种DNA甲基转移酶所调控的,但是只有DNMT3B与通过使抑癌基因沉默致癌这种方式有关,在这次的研究之中,通过使用条件限定下的小鼠模型,我们分析了DNMT3A在肺癌中扮演的角色。我们发现,DNMT3A的缺失,促进了肿瘤生长和肿瘤的进展,而不是肿瘤的发生,基因表达的改变,表明DNMT3A的缺失影响了癌症恶化的关键步骤,比如血管的生成,细胞的粘附,细胞的运动,持续促进了恶性增殖的发生,我们的结果表明DNMT3A表现得像是肺癌进展中的抑癌基因,并且可能会成为肺癌恶化的一个决定性因素。
DNA甲基化状态的改变是癌细胞中最常见的分子水平上的变化,基因组低甲基化和启动子高甲基化是各种各样的癌细胞肿瘤化的标志,整体的低甲基化能够会使得基因组更加不稳定,沉默表达的寄生基因的激活以及基因印记的缺失,然而基因启动子CPG岛的甲基化能够沉默抑癌基因的表达会影响重要的细胞进程,比如细胞周期的控制,细胞凋亡,DNA的修复,细胞相互作用以及血管的生成。
DNA甲基转移酶DNMT3A和3B在胚胎早期的发育中是高度表达的,在高度分化的体细胞中是低表达的。但是,在人类癌细胞中DMNT3B通常是过度表达的,这与DMNT3B的不适宜的表达会使抑癌基因沉默,并且因此会导致肿瘤的发生是相一致的。基于组织特异性基因的缺失和诱导,DMNT3B被小鼠模型识别用来实施人类肠道癌沉默表达的基因甲基化并去促进肠癌的形成。同DNMT3B相比,癌症中DNMT3A扮演的角色较少的为人所知,研究发现,DNMT3A在一些人类癌症细胞和一个老鼠的移植瘤模型中是过表达的。对DNMT3A基因敲除后发现此举抑制了胎记瘤的生长和扩散与之相反的是,DNMT3A对APC小鼠的诱导于其肠道肿瘤的形成并没有影响,人类癌细胞中的DNMT3A扮演的角色在一个报道约20%的白血病患者有DNMT3A的突变中显得非常重要了,这些突变的出现与酶活性的降低还有基因区域低甲基化有关,DNMT3A突变也被证实存在于8%的骨髓异常增生的患者身上,在所有的报道当中,DNMT3A的突变与不良预知相关。
在美国,肺癌是众多癌症中主要的致死癌症。且可以分为四种类型,肺腺癌,鳞状细胞癌,大细胞癌,小细胞肺癌,肺腺癌(简称AD)是最常见的肺癌。
先天因素和后天因素均与肺癌有关,原癌基因的突变是最普遍的基因损伤并且能在许多肺癌细胞中找到此突变,启动子的高度甲基化可能是后天最有特点的后天性失常的因素,并且可以用于早期检测,预防,预知的筛选标记。
在这篇研究当中,我们建立了一个实验系统,来调查肺腺癌中的DNMT3A所扮演的角色,我们发现 ,DNMT3A在原癌基因突变中的缺失诱发了肺癌细胞显著地发展,表明这个基因功能像是一个抑癌基因。
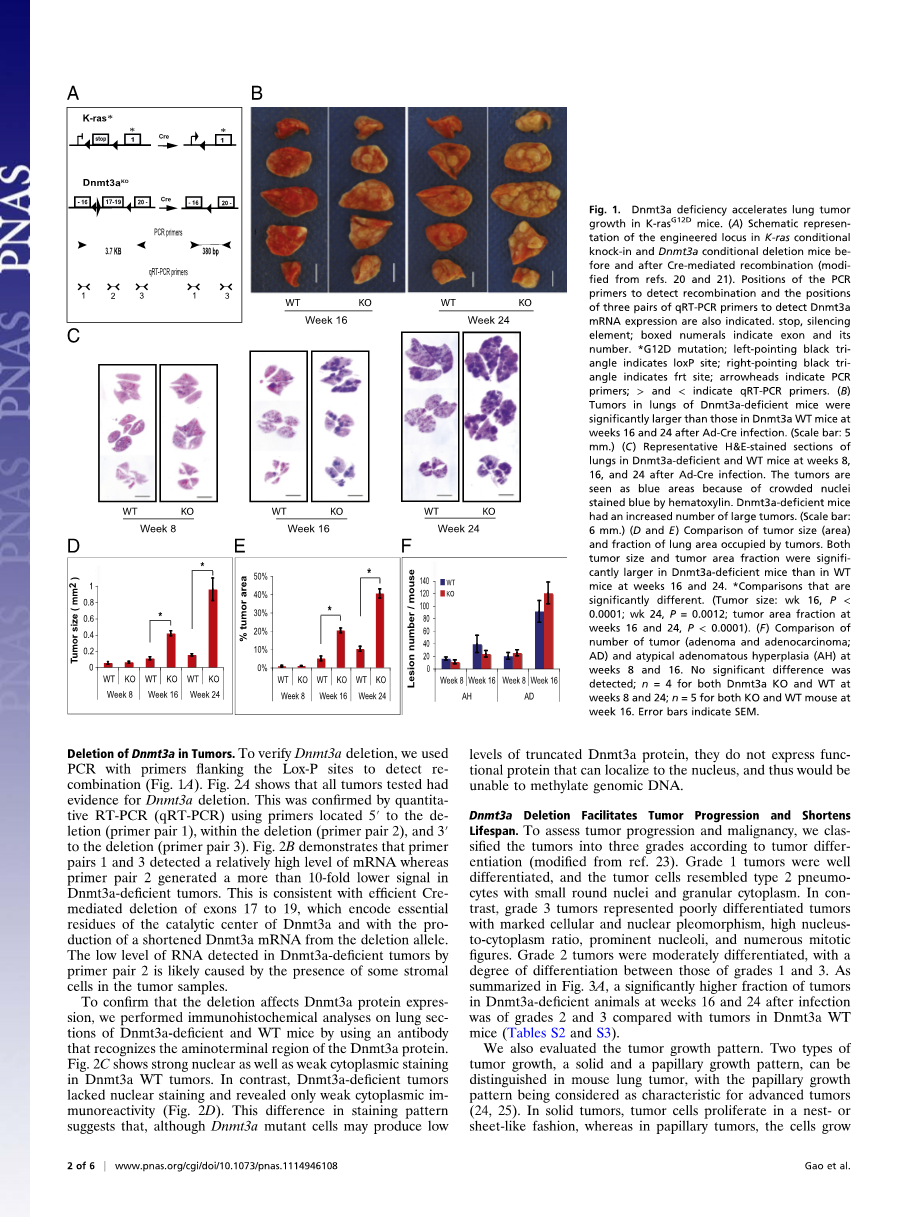
结果:DNMT3A的缺失促进了肿瘤的增长。为了测试DNMT3A的缺失在肺癌细胞中的效果,我们培养了带有。。。。?四种小鼠,致癌基因的激活和DNMT3A的缺失由灌入气管内的腺病毒的Cre重组酶诱发。
肺部感染的动物在灌入腺病毒Cre重组酶以后被隔离并且分别在8周,16周,24周后准备肺部组织检查,感染动物们的肺部肿瘤数量和型号在第八周时并没有显著差异,相比较起来的DNMT3A缺乏的小鼠和野生型小鼠在感染后的16周和24周出现了显著地差异。然后大多数含有DNMT3A的野生型小鼠肺部肿瘤依然很小(直径约0.2cm),缺乏DNMT3A的小鼠肺部大块肿瘤的数量明显上升,这由组织切片所证实。由图D可知, DNMT3A缺陷的小鼠肿瘤与含DNMT3A的野生型小鼠肿瘤在16周,24周时相对比,前者肿瘤平均大小大约分别为为后者的4倍和6倍,相似地,前者的肿瘤占肺部面积为后者的4倍(16周,24周相同),然而,肿瘤的总数量(腺瘤和肺腺癌)还有非典型的腺瘤增生(癌症形成前的损害)在两者之中并没有显著的差异(图 1F 和 表 S1 还有 S2).
这些结果表明,DNMT3A的缺失并没有影响原癌基因的启动诱发肺部肿瘤而是大大促进了肿瘤增长。
肿瘤中DNMT3A的缺失。为了验证DNMT3A的缺失,我们用了带引物侧翼的L-Pox位点的PCR技术来检测重组(图1A)图2A表明所有的肿瘤测试都有DNMT3A缺失的证据,这由定量的RT-PCR技术从5rsquo;端到缺失端(引物对1),缺失端内部(引物对2),3rsquo;端到缺失端(引物对3)所证实。图2B说明引物对1,3检测到相关的高水平的 mRNA然而引物对2发现了10倍的下游DNMT3A缺失的肿瘤信号,这与外显子17-19Cre调节的缺失是相一致的,它编码了DNMT3A接触中心的重要的残留物,随着等位基因缺失变短的DNMT3A mRNA的产生,低水平的RNA通过引物对2在DNMT3A缺失的肿瘤中检测出来,很可能是由于肿瘤细胞的组织基质的存在造成的。
为了证明缺失影响了DNMT3A的蛋白质表达,我们用一种能辨认DNMT3A蛋白氨基末端的抗体对DNMT3A缺陷和野生型小鼠肺部区域进行了免疫组织化学分析,图二显示了DNMT3A野生肿瘤中的颜色亮的细胞核还有黯淡的细胞质染色,与之相反,DNMT3A缺失的肿瘤缺乏核染色,只有淡淡的细胞质免疫反应,显色形式的不同表明DNMT3A,尽管DMNT3A的突变细胞可能产生低水平的除去顶端的DNMT3A蛋白,它们并没有表达功能性的能够集中细胞核的蛋白质,所以不能将基因组DNA甲基化 ,
DNMT3A的缺失促进了肿瘤的发展并且缩短了生命值
为了评估肿瘤的发展和恶性肿瘤,我们依据肿瘤的分化程度将其分为三个等级,第一等级的细胞,肿瘤细胞像类型2的肺泡壁细胞,带有小圆的细胞核和颗粒状的细胞质,与此相反,第三等级的肿瘤代表了分化不良的的肿瘤,带有细胞的和细胞核的多形性,高核质比,突出的核仁,还有许多有丝分裂的特征,第二等级的肿瘤是中度分化的,其分化程度介于第一等级和第三等级之间。如图3A所示,感染后16周和24周的DMNT3A缺陷的动物相对野生型而言(如表S2S3)有高比例的肿瘤。
我们也评估了肿瘤生长的模式,两种类型的肿瘤增长,一种是固体的乳头状突起的增长模式,能在小鼠的肺部肿瘤中区分开来,这种乳头状突起的增长模式被认为是晚期肿瘤的经典模式(24,25),在固态瘤中,肿瘤细胞的增殖环绕一个纤维管束核心(图3B),相对固态增殖模式而言,乳头状能使肿瘤细胞更有效地解接触血液循环,这对肿瘤的生长和发展是至关重要的,图3B表明,比起控制下的野生型小鼠(表S2和S3),DNMT3A缺陷型的小鼠在感染后16周和24周均有较高比例的乳头瘤,最终我们在DNMT3A缺陷的肿瘤中,观察到了肿瘤侵袭(图3C),但野生型没有。
与肿瘤的高负载相一致,肿瘤的类型越是恶化,DNMT3A缺陷型的小鼠寿命越是比野生型和DNMT3A杂合型的小鼠寿命短(图3D)
,而野生型和杂合的则没有观察到明显区别,对于70只小动物的尸检结果表明肺癌是它们致死的最主要的因素。
DNMT3A缺乏的癌细胞有高幅度增殖的指标:为了调查促进DNMT3A缺陷型小鼠肿瘤增长的基本因素,我们通过免疫染色和增殖标记KI67和细胞凋亡标记的细胞凋亡裂解酶检查了细胞增殖指数和细胞凋亡指数.如图四AC表明相对野生型肿瘤而言,DNMT3A缺陷型小鼠肿瘤KI67检查呈的阳性细胞单位密度更大,表明DNMT3A突变肿瘤是以高速增殖指数为特点的,与此相反,细胞凋亡裂解的阳性细胞数量稀少,而且在DNMT3A缺陷型和野生型小鼠中两者乳头瘤的差异并不显著(如图4D),这些结果表明增长的DNMT3A缺陷的肿瘤是细胞增殖的增强而不是细胞凋亡的减弱作用的结果
DNMT3A缺陷的癌细胞中基因的表达和DNA甲基化
为了深入理解基因表达的改变,我们用老鼠的基因组芯片做了转录的性能分析,12对野生型肿瘤和DNMT3A突变型肿瘤对比显示mRNA充裕的大约1970个基因在两者之间差异显著,缺陷型中大约1020个基因存在高水平表达940个基因低水平表达(图5A和资料S1)基因本体论的丰富分析透露了前三的生物进程很大程度上被差异的基因影响的是血管的形成,细胞粘附还有细胞移动,(图5B和资料S1)这些过程是癌症扩散的重要步骤,与形态学的发现相一致,DNMT3A缺陷型的肿瘤更大更高级。而mRNA的丰富度在DNMT1伙食DNMT3B上而言,野生型和DNMT3A缺陷型两者差异不大, 为了检查DNMT3A的缺陷会不会影响甲基化,我们进行了一项公平的甲基化分析,从三份DNMT3A缺陷型和两份野生型的肿瘤通过免疫沉淀法分离甲基化的DNA,并且使用高通量测序(甲基化DNA免疫沉淀反应MeDIP测序)产生了1亿零100万的已测定序列,由于CPG岛的密度依赖于甲基化DNA免疫共沉淀测序使其富集,我们对位于DNMT3A缺陷型肿瘤和野生型的特定区域只分析了相关甲基化水平,为了验证甲基化区域性的差异,我们绘制了测定的序列,用100bp的折叠扫描了1Kb的窗口基因(材料和方法),我们观察到99.6%的DNMT3A突变型肿瘤的差异甲基化区域的甲基化程度低于突变型的甲基化程度(表S4和数据S2)基于它们整体在基因上的分布,高于预期百分比的低甲基化区域折叠了基因主体,尤其是外显子(表S4)我们进一步测试了所有的差异的甲基化基因还有启动子区域(材料和方法见数据S2)并且观察到了缺陷型肿瘤较少表达的基因倾向于有低甲基化的基因主体(图S1A),比较起来说,基因表达的改变并没有与启动子的低甲基化一一相对应(图S1B),这些结果与之前的一篇报道是相一致的,表明了基因主体的低甲基化
和在DNMT3A缺陷型的神经培养当中基因的表达,表明
DNMT3A调控非启动子甲基化促进了基因的表达(28)。
之前的研究表明,甲基化关于重复系列的改变是存在于
DNMT3A突变的ES细胞中的,因此,我们因此进行了印记杂
交甲基化试验,对比DNA甲基化身份和次要的重复序列在
DNMT3A缺失体和野生型中差异较大(图S2),这表明
DNMT3A依赖的关于这些序列的甲基化改变只在大量细胞传
代和增殖之后才出现。
讨论
APCmin模型角色的DNA甲基化在肠道肿瘤中很好地被建立
起来,在DNMT3B的缺失防护抑制了肿瘤的发生,还有过表
达增加的肿瘤负载并且通过重新甲基化和沉默抑癌基因
(9,10)与此相反,没有DNMT3A的基因角色在APCMIN肿
瘤形成中被建立起来,我们发现DNMT3A的缺失促进了肿瘤
的增长和发展,但是没有肿瘤的启动,表明这个基因,与预
计的相反,像是抑癌基因而不是原癌基因,就像DNMT3B所
展示的那样,基因表达所涉及的许多过程,包括血管生成,
细胞粘附和细胞移动,它们在DNMT3A缺陷的肿瘤中都是异
常的,这与在肿瘤增长和发展是相一致的。
DNA的甲基化身份有一些机制来影响癌症,整体的低甲基
化可能增加基因的不稳定性,启动子的不稳定性可能调控抑
癌基因的沉默,然而DNMT3A是如何影响基因表达和肿瘤
形成的机制还是未知的,胚胎干细胞的基因,与体细胞相比,
在非CPG岛环境,有甲基化的胞嘧啶残留物。这表明是
DNMT3A活动的结果,最近,整个基因组DNA甲基化调控
在ES细胞碱基对中发现非CPG岛区域的基因主体的甲基化
是积极地与基因表达相一致的,另外一个研究表明DNMT3A
依赖的基因主体甲基化与基因表达涉及核差异相关联(28)
与观察相一致,我们发现基因主体在DNMT3A缺陷的肿瘤
中比起野生型是低甲基化的,这也与基因低表达是相一致的,
给出在原癌基因突变的肺癌模型中的肿瘤可能引起肿瘤中
的干细胞分化(32)可能DNMT3A依赖的基因主体甲基化
是基因表达的非常重要的一个部分,促进了肿瘤细胞的分化
尽管内部机制是缺乏的,我们观察到的DNMT3A缺陷型的小鼠肿瘤分化的并不好,而且有很多的晚期的肿瘤也是这样,这与DNMT3A的缺失干扰了癌细胞的分化过程有关。因而促进了不成熟的癌细胞和更恶性的肿瘤的形成。
大多数在骨髓增生的患者身上的DNMT3A的突变是错义突变,一些突变已经表明或者能够预测会导致翻译的减少,然而,几乎所有的患者都是突变等位基因杂合的,这就搞不清楚是否DNMT3A的突变有阳性还是阴性的效果,还是造成了杂合子机能不全的情况,在这个环境当中我们的数据出于兴趣使用了DNMT3A无效的等位基因,当他们争辩杂合子无效的影响肺癌的可能性。
基于建立起的较好的DNA甲基化调节在癌细胞基因沉默的模型,甲基转移酶抑制剂在使用中被激活,另外两种药品阿扎胞苷和地西他滨是经食物药品管理局批准用来治疗骨髓异常增生综合征的,我们的数据支撑了这种治疗方法的可行性,为了激活沉默抑癌基因的基因,可能会有意外地抑制DNMT3A基因,因此,这种影响
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[148847],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 纳米材料介导镉污染土壤原位修复的机理及研究进展外文翻译资料
- 纳米零价铁磁洗受镉污染水稻土壤的有效性验证外文翻译资料
- 镉对水稻叶片生长和养分运输的短期影响外文翻译资料
- 间接竞争ELISA的研制及可视化基于金纳米棒生长的多色酶联免疫吸附试验玉米赤霉烯酮的测定外文翻译资料
- 铅(Pb)诱导的小麦根系生化和超微结构变化外文翻译资料
- 用蚕豆根尖微核试验评估污水灌溉区和生物修复区土壤的遗传毒性外文翻译资料
- 镧在红土壤中的生物累积和其对玉米幼苗生长的影响外文翻译资料
- 铈对水稻幼苗生长及部分抗氧化代谢的影响外文翻译资料
- 用黄体孢子菌沉淀碳酸盐固定有毒金属的体外研究及其在含硫化物尾矿中的应用外文翻译资料
- 水牛妊娠早期生物标志物的编码序列克隆及部分序列密码优化后在大肠杆菌中的表达外文翻译资料


