
英语原文共 17 页,剩余内容已隐藏,支付完成后下载完整资料
固有无序蛋白与生物矿化
摘要:
在脊椎动物和无脊椎动物中,生物矿化由细胞和它们产生的蛋白质调控。许多这种蛋白质本质上是无序的,当它们与其结合配偶体相互作用时获得一些二级结构。这些配偶体包括沉积矿物的组分离子,晶体本身,初始晶体形成的模板和其他本质上无序的蛋白质与多肽。本文推测了为什么固有无序蛋白质对生物矿化如此重要,并从SIBLING蛋白及其肽中提供插图。得出的结论是有灵活的结构并且与固有无序蛋白质能够结合多个表面有很大关系,但关于精确的相互作用,能量学和结合动力学的细节仍有待确定。
介绍
矿化组织的组成
生物矿化发生在各种生物体中,从含有金矿床的单细胞细菌到具有硅基矿物沉积物的硅藻,碳酸钙相(霰石,方解石和偶尔的球霰石以及无定形碳酸钙)的壳层到脊椎动物骨骼和牙齿中的分层结构 含有磷酸钙,羟基磷灰石(HA)。这些矿化结构的共同特征是(1)在由该生物体的细胞产生的有机基质上形成。每个生物体内或其组织内的有机基质,细胞外或细胞内,在矿化过程中起作用。这是众所周知的,因为观察到基质或基体中任何给定的组分的去除或修改改变了其性质,从而改变了形成矿物的方式(表1)。(ii)调节矿化的基质蛋白的另外一个特征是其中很大部分是固有无序蛋白质(IDPs).,所占的比例比普通蛋白质数据库中的大的多。本文中,我们得到的结论是 IDPs在生物矿化中是必不可少的,并提供举例来说明其重要性。
矿化过程概述
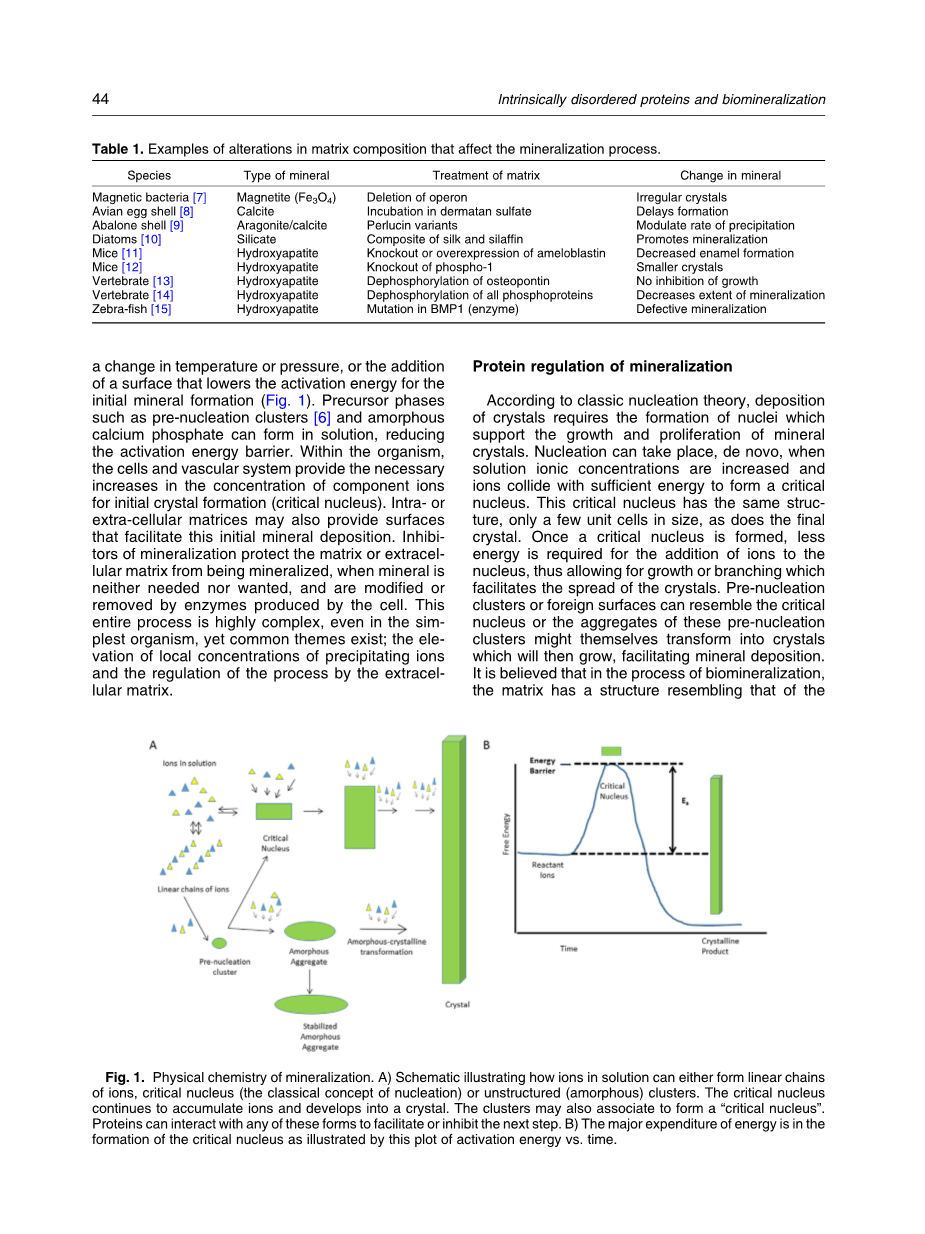
矿物沉积是一种物理化学过程,在活生物体中,由细胞及其产生的细胞内和细胞外基质调控。在纯粹的化学术语中,矿物不会沉淀,除非它的溶解度超过其组分离子的浓度增加,温度或压力的变化,或增加表面的降低活化能的初始值来促使矿物形成(图1)。前体相如预成核团和无定形磷酸钙可以在溶液中形成,从而降低活化能垒。在生物体内,细胞和血管系统提供了初始晶体形成时组分离子浓度的必要增加。细胞内或细胞外基质还可以提供促进这种初始矿物沉积的表面。当矿物不需要时,矿化的抑制剂保护基质或细胞外基质不被矿化,并且被细胞产生的酶修饰或除去。这个整个过程是非常复杂的,即使在最简单的生命体中,但也存在共同的主题; 沉淀离子的局部浓度升高和细胞外基质的过程调节。
蛋白质调节矿化
根据经典成核理论,晶体沉积需要形成支撑矿物晶体生长和增殖的核。当溶液离子浓度增加并且离子与足够的能量碰撞以形成临界核时,核可以从头开始形成。这个临界核具有相同的结构,只有少量晶胞大小,和最终的晶体一样。一旦形成临界核,就只要更少的能量便可以使离子吸附到核上,从而允许生长或分支,这有利于晶体的扩散。预成核团簇或外来表面可以类似于临界核,或者这些预成核团簇的聚集体本身可以转变成晶体,然后生长,促进矿物沉积。人们认为在生物矿化过程中,基质具有类似于所形成的结晶相的结构,并且在该表面上发生外延成核。我们知道,如果一种蛋白质可以作为外延成核剂与矿物结合,它也可以涂覆矿物表面并调节该矿物的大小或形状。最近在使用肽和蛋白质的HA结合研究中已经发现这种现象。极有可能控制多细胞生物体矿化的蛋白质的功能也是多余的,因为矿化的模式在整个生物体的不同组织中可能不同,并且因为矿化对于生命本身很重要。在更复杂的生物体中,通过原子级分子模拟证明的模板,例如用于骨的胶原蛋白,或者在牙釉质形成过程中自组装的牙合蛋白纳米球的基质可以与调节矿化过程的其它蛋白质相互作用。在这里,IDPS变得重要。
固有无序蛋白(IDP)
IDPs是其结构高度可变的蛋白质,并不代表典型的二级结构(alpha;-螺旋,beta;-片等)。这些蛋白质中的一些具有无规则卷曲结构; 其他的,有内在无序的区域。IDP通常是亲水性的,具有多个氨基酸重复序列,通常具有带非常大的负电的或带正电的结构域。IDPs在翻译后修改时或者与配体结合后获得许多折叠结构(图2)。这些被结合的物质也可能具有不同的结构和功能。IDPs研究近年来有了广泛的发展,因为这些蛋白质与主要疾病如分裂症和阿尔茨海默氏病等有关。在脊椎动物生物矿化中,除了实际上具有无序的远视肽,小的富含亮氨酸的蛋白多糖和一些酶之外,胶原蛋白除外,最近回顾的大部分与HA形成和生长相关的蛋白质都是IDP。这些IDPs可以稳定离子或离子簇,临界核,提供初始矿物沉积的外延位点以及稳定晶体。这些结构的灵活性使其能够执行这些和许多其他功能。非结构蛋白参与矿化的观察首先在1977年在磷光体的圆二色性研究中被报道,在钙离子存在下,随着这种离子的添加,从随机线性链变为beta;-折叠片...
釉质中的HA形成:IDPs的作用
釉质的形成是一个复杂的过程,随着有机基质被去除,形成HA晶体,也同样依赖于IDPs。Janet Moradian-Oldak和她的合作者John Evans和Wendy Shaw研究了两种主要牙釉质蛋白质的二级结构。两者都显示为IDPS,其结合体是其他IDPs(釉蛋白和釉丛蛋白)和HA。胶原蛋白基质上不会发生釉质形成; 而是在前面提到的IDPs的指导下形成。牙釉质形成细胞(细胞),产生几种IDPs:牙釉蛋白,成釉蛋白,和釉质素。这些IDPs最终通过酶例如釉质素和激肽释放肽4被切成较小的片段。这些蛋白质指导釉质中HA形成的方式是未知的。然而,最近的研究有一些重要的线索。在产生截短形式的成釉细胞的小鼠的牙齿中,釉质不能出现。这些小鼠也降低了牙釉蛋白的表达,几种其他成釉细胞产生的蛋白质的水平没有明显的变化,表明在矿化过程中,在牙釉蛋白和成釉蛋白之间必须有一些相互作用。在不同的发育阶段研究小鼠成釉细胞,Moradian-Oldak报道了在其形成的最初阶段,在成釉细胞分泌面附近共同定位的球蛋白和成釉蛋白; 随着成熟,釉质表面失去了成釉质素。此外,他们发现使用圆二色性,牙釉蛋白和成釉细胞可以形成稳定的复合物。从细胞外基质成熟失去的完整成釉细胞的C末端被切割成较小的肽。这意味着这些IDPs的相互作用可能有助于特异性切割。观察到一些具有形态不完整的患者的朊蛋白原蛋白形成聚集体支持了具有IDP样柔性结构与矿化过程密切相关的概念。此外,Wendy Shaw的研究小组使用核磁共振光谱法检测WT小鼠和突变体的蜕皮素蛋白,以确认突变蛋白的成熟前自组装。其他研究表明,在与HA,磷脂,其他釉质蛋白质甚至胶原蛋白相互作用过程中,牙釉质素结构如何被修饰(记住,牙釉蛋白不与原位胶原相互作用),这表明在导致HA形成的复杂相互作用过程中,其他构象变化正在发生。
初步形成釉质晶体的冷冻透射电镜研究已经提供了高分辨率的洞察IDPs,牙釉蛋白与前核团簇相互作用的方式。在磷酸钙溶液中,釉原蛋白的存在稳定了小颗粒,使两个或三个颗粒聚集和形成较大的聚集体(预成核团)。虽然最终形成了羟基磷灰石的针状颗粒,但是无定形聚集体通过牙釉蛋白稳定,导致朊蛋白酶抑制(延迟)矿化的说法。值得注意的是,碳酸钙前核聚簇的原子模型表明它们也由阳离子和阴离子链组成。 这种链的形成也可以是磷酸钙预核簇的真实情况。
病理钙化:IDPs的作用
发生在不需要的地方 - 主动脉,唾液腺和软组织的钙化都与IDPs有关。例如,当粘蛋白(如statherin,一种未折叠的蛋白)有缺陷时,会产生唾液结石。Statherin,一种唾液腺分泌的IDP,可以结合细菌并调节釉质暴露于其中的钙和磷酸盐的量,涉及预防牙结石形成。Statherin,其也控制唾液中的HA成核和生长,包括在SIBLING蛋白中也发现的具有小酸性基序(DSpSpEE)的N-末端。当溶解时,statherin具有无规卷曲构象。当与HA结合时,其具有暴露细菌结合位点的更多alpha;螺旋结构,导致细菌截留。
IDP另一个例子是DMP1,在预防肾脏和心血管钙化中的作用。缺乏DMP1和Klotho(调节磷酸盐水平的肾跨膜蛋白)的双重敲除小鼠,在不存在DMP1的情况下,发生与无法管理高磷酸盐水平相关的肾脏和心血管钙化。第三个例子由胶原病提供。与营养不良的大疱性表皮松解症相关的VII型胶原的铰链区也是固有无序的。此外,SIBLING蛋白质,所有IDP也与血管和其他软组织钙化有关。由于它们的基因在与这些沉积物相关的细胞中表达,所以它们不能由于它们对HA或胶原蛋白的亲合力而不能累积,而是它们在沉积这些不想要的钙化时必须具有一些功能。
...
IDP作用的潜在机制:生物矿化
必须有确切的原因,为什么这么多的IDP蛋白质与矿化有关。我们的建议是,由于以下原因:i)存在IDP的初始矿物沉积的能量更有利。即,当非结构蛋白质被结合和折叠(瞬时地)时,由于熵Delta;S的变化,将IDP与胶原蛋白,前体矿物相或HA结合所需的驱动力(自由能)较低 ,小于当结构蛋白结合时的能量(Delta;G=Delta;H-TDelta;S)。然而,这个概念可能是由于IDP与水性介质中的IDP伴侣结合后水的紊乱的相对顺序而被讨论的。ii) 开放结构使得IDP能够绑定到多个伙伴并且呈现不同的表面以促进矿化的调节。iii) 开放式结构有助于翻译后修饰,其可以通过磷酸化和糖基化等改变IDP净电荷,从而提供更大的结构变异性,为新配体打开大门,使得IDP可以作为成核剂,抑制剂或两者兼有。上述各种组合可能在原位存在。
IDPs一般具有多种功能。与其灵活的链条相关的生物制剂相关IDPs具有若干可能的功能,这取决于上述提出的机制,可能包括:
(a)磷酸钙纳米团簇或非晶态磷酸钙ACP的稳定化。例如,已知乳蛋白酪蛋白和SIBLING蛋白质骨桥蛋白的非结构链可以稳定ACP。最近的中子光谱学,小角度X射线和骨桥蛋白磷酸钙相互作用的中子散射证实,骨桥蛋白1-149片段在溶液中保持其柔性线性链结构,稳定ACP颗粒。最近的中子光谱学,小角度X射线和骨桥蛋白磷酸钙相互作用的中子散射证实,骨桥蛋白1-149片段在溶液中保持其柔性线性链结构,稳定ACP颗粒。此外,碳酸钙纳米粒子的稳定化和纳米孔隙度的产生是由于上述讨论的IDP软体动物蛋白AP7,这意味着这可能是常见的IDP矿物调节机制。如其他地方所述,形成的初始矿物质,无定形液体或预成核链或团簇可能表现出多变质。所形成的一个或多个非晶态相可以被IDP稳定,在一些情况下有利于转变成结晶相,而在另一些情况下则提供了保持在非晶状态的手段。这些非晶结构中的一些具有短范围的顺序可以被认为是原始结晶。对于无定形碳酸钙,仅在添加剂如聚天冬氨酸存在下才能注意到这种短程序。由于无定形结构聚集形成核心前团簇,这表明前核心簇也具有短程序列,这可能与IDPs的存在有关,反过来又可以确定是否存在无定形与晶体转化, 形成了什么阶段。
(b)能够形成超分子结构,如上所述和如下所示:i)釉质和成釉细胞,ⅱ)胶原,IDP和矿物,或iii)肽 - 两亲物被用于骨骼再生开发的络合物。成胶质细胞凝胶自身结合长度(10-100nm)带状结构,平均宽度和厚度为18和0.34nm。如何调节釉质矿化正在调查中,但重要的是要记住当不存在成釉细胞素时矿物质形成不发生。
(c)允许对于牙齿和骨骼的各种SIBLING蛋白质存在的翻译后过程的变化。这被SIBLING蛋白质所证明,SIBLING蛋白在不同组织中经历广泛和可变的翻译后修饰,促进它们与其结合配偶体(细胞表面整合素,HA,Ca 2和胶原)的相互作用。当磷酸化时,它们都是高度酸性的。这些蛋白质及其肽的磷酸化程度影响其结合HA和调节矿化的能力。通过分子动力学模拟对DPP中最常出现的重复肽进行建模,显示磷酸化肽以更高的亲和力结合,并且具有更有组织的结构到羟基磷灰石的表面(图3A,B)。通过圆二色性,小角度散射和振动光谱验证了磷酸化后与钙离子或羟基磷灰石相互作用的更有序结构的变化(图4)。基于建模,当与I型胶原模型相关时,与非磷酸化肽相比,磷酸化肽折叠不同(图5)。这些与翻译后修饰相关的构象变化可以促进矿物晶体在胶原基质上和内部的成核和生长。
(d)调节细胞内的蛋白质表达。DMP1,一个,通过控制激素FGF23的骨表达调节循环磷酸盐水平。IDPs承担许多不同的功能,因为它们的“展开”结构呈现出许多表面,使得它们能够与多种酶,细胞膜和其他结合物相互作用。然而,总体来说,为什么IDPs与生物矿化有关并且是生物矿化所必需的。可能有争议的是,IDPs是由基因倍增引起的,并且与矿化过程有关。 (例如,DSPP是DMP1的复制产品)。IDPs在矿化中如此普遍存在的观点反对这个。已知IDPs与多个绑定方“混杂”。 这种滥交最有可能是由于IDPs提出的多个表面或与其在矿化中的作用相关的低能量需求。因此,DMP1可以与细胞膜受体(例如alpha;vbeta;3整联蛋白调节信号传导,FGF23表达,结合HA晶体,以调节HA生长,与自身和胶原相互作用以调节牙质和骨矿化)相互作用并不奇怪。从MEPE,DPP和DMP1释放的ASARM(酸性丝氨酸天冬氨酸富集基序)肽在调节,血管化,软组织钙化,破骨细胞形成,机械转移,脂肪能量代谢以及矿化调节中起作用。如图4所示,IDPs还与我们的组织报告的DPP和OPN以及Clarkson的DSP和DPP与釉质晶体相互作用的相互作用。
迄今为止,除了上述研究之外,原子论建模已经提出了IDPs调节生物矿化的方法。例如,基于骨涎蛋白结构的不同结构域的建模,首先发现ser-136必须被磷酸化才能发生HA成核。相比之下,另一项研究报告说,没有涉及成核的领域。使用较大部分的分子进行建模,后来发现阳离子环区通过吸引Ca 2 离子促进成核,环的灵活性允许用磷酸根离子快速自组装,而不是提供用于结晶的规则模板 。当与HA表面结合时,骨桥蛋白结构的灵活性也通过分子动力学预测; 这些研究中肽修饰结合的磷酸化,如与草酸钙相互作用的研究。这些数据引导Hunter组提出,酸性蛋白质吸附到富含Ca 2 的矿物晶面上是由静电现象所决定的,并由链的构象柔性促进。这些和其他原
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[140435],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 纳米材料介导镉污染土壤原位修复的机理及研究进展外文翻译资料
- 纳米零价铁磁洗受镉污染水稻土壤的有效性验证外文翻译资料
- 镉对水稻叶片生长和养分运输的短期影响外文翻译资料
- 间接竞争ELISA的研制及可视化基于金纳米棒生长的多色酶联免疫吸附试验玉米赤霉烯酮的测定外文翻译资料
- 铅(Pb)诱导的小麦根系生化和超微结构变化外文翻译资料
- 用蚕豆根尖微核试验评估污水灌溉区和生物修复区土壤的遗传毒性外文翻译资料
- 镧在红土壤中的生物累积和其对玉米幼苗生长的影响外文翻译资料
- 铈对水稻幼苗生长及部分抗氧化代谢的影响外文翻译资料
- 用黄体孢子菌沉淀碳酸盐固定有毒金属的体外研究及其在含硫化物尾矿中的应用外文翻译资料
- 水牛妊娠早期生物标志物的编码序列克隆及部分序列密码优化后在大肠杆菌中的表达外文翻译资料


