用玻璃化法冻存日本陆生兰(白芨)的合子胚
原文作者 K. Ishikawa · K. Harata · M. Mii · A. Sakai
K. Yoshimatsu · K. Shimomura
收到日期:1996年9月19日/修订日期:1997年1月3日/接受日期:1997年2月24日
摘要:使日本陆生兰(Bletilla striata Rchb.f.)的种子发芽并在固化的新堂岛(ND)培养基上培养10天。 然后,在25℃下连续黑暗环境中,将这些胚胎在添加有0.3M蔗糖的ND培养基上预培养3天。 随后用2M甘油和0.4M蔗糖的混合物将胚胎在25℃下覆盖15分钟,最后在0℃下用高浓度玻璃化溶液(PVS2)脱水3小时,然后浸入液氮中30分钟。 快速升温后,用添加了1.2M蔗糖的液体ND培养基洗涤胚胎20分钟,然后在ND培养基上植板。 成功玻璃化和处于保暖状态的胚胎发育成正常的小植株。 植物再生率约为60%。 这种玻璃化方法可能是一种很有前景的用于冷冻保存兰花的技术。
关键词 白芨;低温保存;胚胎;兰花;玻璃化
缩写词ND medium 新堂岛培养基·PVS2 植物玻璃化溶液·TTC 2,3,5-三苯基四唑氯化物
通讯作者:F. Constabel K. Ishikawa(permil;)·K。Harata·M。Mii植物细胞技术实验室,园艺学院传播,千叶大学,松户市松户市648,千叶271,
日本传真号码: 81-473-66-2234
电子邮件:ishikawa@midori.h.chiba-u.ac.jp
A. Sakai日本北海道札幌市北区麻生町1-5-23K. Yoshimatsu·K。Shimomura筑波医疗植物研究站,国立卫生科学研究所1八幡道,Tsukuba-City,茨城305,日本
引 言
多种兰花物种在体外容易发芽,而且没有种子休眠的迹象。然而,在实验室条件下(Rasmussen 1995)储存的一些兰花种子,我们已经观察到其发芽率的快速丧失。例如,在从母体植物中释放出来后,在无菌条件下,杂交种子通常会立即在营养培养基上发芽。发芽后,每隔几个月,胚胎都必须进行几次传代培养,然后不断适应水平直至开花。由于所涉及的劳动量和有限的空间,在育种者观察第一朵花之前,超过90%的原球茎会被丢弃。 就存储而言有关,为了维持4-8个月的白色或棕色,大花蕙兰原球茎要保存在1°C的条件下,并且恢复到24°C后,需要4-5个月时间来恢复其正常生长(Sakawa 1990)。没有兰花植物其他部分长期储存的相关报道。整个兰花植物能很容易的由胚胎或原球茎这种非常小的器官发育而来。 因此,研发胚胎或原球茎的长期保存方法对于保护兰科植物种质,育种计划和兰花卉产业都是非常重要的。
简单可靠的低温方案,如简化冷冻(Sakai等,1991a),玻璃化(Langis等,1989; Sakai等,1990; Yamada等,1991),包封/脱水(Dereuddre等,1990; Fabre) 和Dereuddre 1990)已展示,而且冷藏物种或栽培品种的数量在过去几年中显着增加(Sakai 1995)。 具有潜在价值的低温程序将把玻璃化和包封/脱水结合起来以用于冷冻保存分生组织,以及合子和体细胞胚。
本次研究的目的是利用白芨(Bletilla striata)(一种具有商业价值的日本陆生兰)开发一种可靠的兰花胚胎冷冻保存方法。
图1播种后的10日龄白芨胚胎(bar=1 mm)
材料和方法
植物材料
成熟豆荚(B. striata Rchb.f.)由T. Godo,日本富山植物园提供。 将秋天收集到的豆荚,放在10℃下具有干燥硅胶的密封金属外壳中储存起来,并用于接下来的实验。 将表面灭菌的种子播种在添加有2%蔗糖和2%结冷胶的固化的新堂岛(ND)培养基(Tokuhara和Mii 1993)上,并在黑暗中于25℃下培养10天。 将10日龄胚胎(直径约0.3mm;图1)在固化ND培养基(培养管(直径2cm)中含有不同浓度蔗糖)中于25℃下,在黑暗中预培养3天。
玻璃化过程
将胚胎(质量体积为0.2ml)转移至2.0ml冷冻管中,然后将其浸入2M甘油和0.4M蔗糖(上样溶液; Sakai等1991a; Nishizawa等1993)的混合物15分钟(25℃)。用巴斯德吸管除去上样溶液后,加入2ml 0℃的玻璃化溶液(PVS2,Sakai等,1990,1991b)并轻轻混合。0.4M蔗糖溶液(pH5.8)中的PVS2中含有30%(wt / vol)甘油,15%(wt / vol)乙二醇和15%(wt / vol)二甲基亚砜。 将在0℃下经PVS2不同持续时间处理过的胚胎直接浸入液氮中并在黑暗中至少保持30分钟。然后将冷冻管于37℃的水浴中快速加热。 从冷冻管中取出所有PVS2,然后加入1ml添加有1.2M蔗糖的液体ND培养基并等待10分钟。 然后,从冷冻管中取出0.5ml溶液,再加入0.5ml添加有2%蔗糖的新鲜的液体ND培养基。 该过程重复五次。
生存率
将经用本文所述的低温流程处理的胚胎放在含有2%蔗糖的固化ND培养基上于25℃在黑暗中培养1天。
通过两种不同的活力测试估算存活率:2,3,5-三苯基四唑氯化物(TTC)还原反应测定和再生长。 根据Rasmussen(1995)进行TTC测试。在25℃连续照射(冷白色荧光,62.0mu;mol·m -2·s -1)的条件下,通过固化的ND培养基上的再生长情况来确定存活率。 在经各种处理之后(大约2周),我们观察到了胚胎的进一步发育。 在胚胎上观察到了绿色斑点,我们以此判断它们的成活。
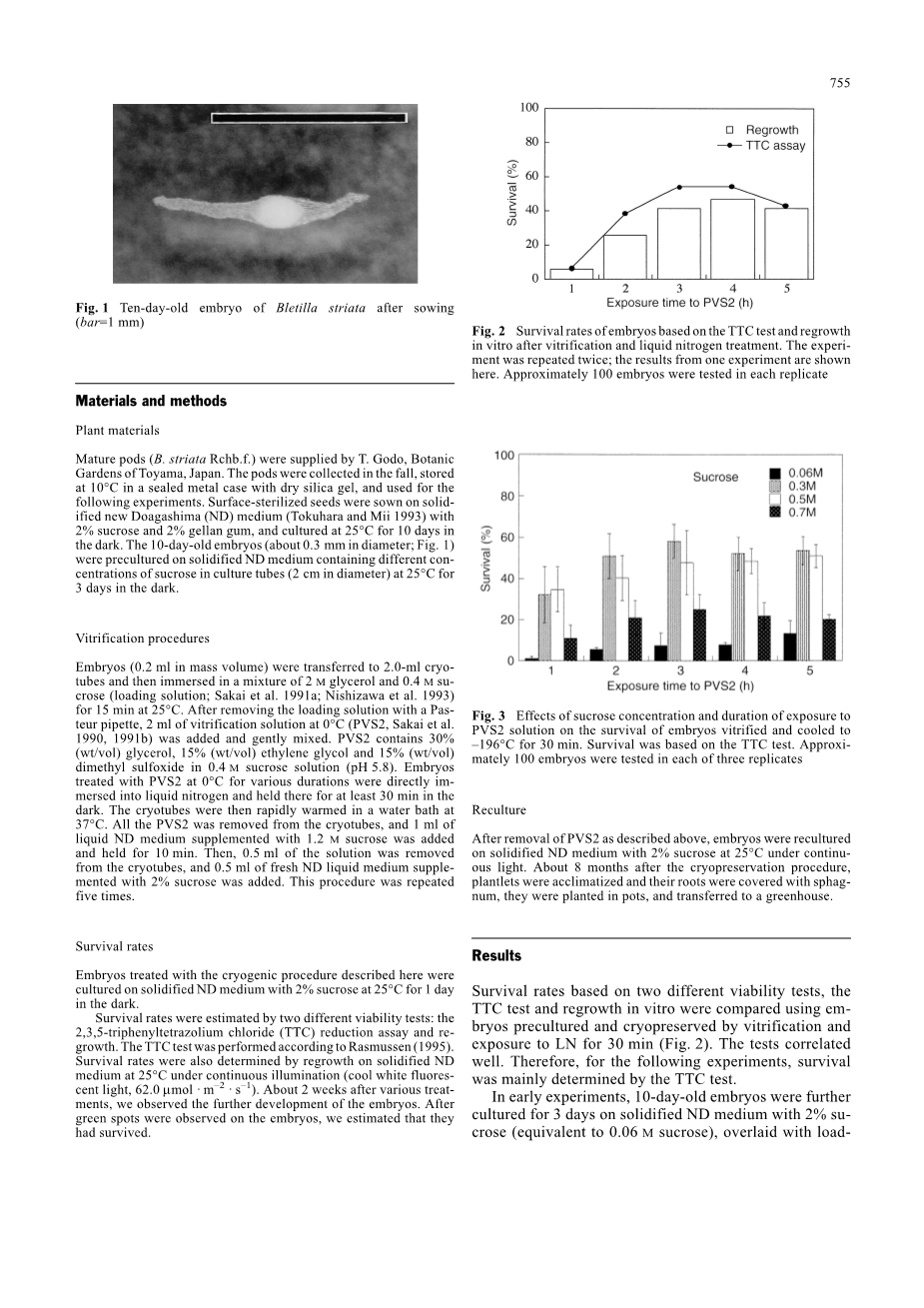
图2基于TTC测试和经玻璃化和液氮处理后的体外再生的胚胎存活率。 实验重复两次; 这里显示了其中一个实验的结果。 在每次重复中大约测试100个胚胎
图3蔗糖浓度和暴露于PVS2溶液的持续时间对玻璃化并冷却至-196℃持续30分钟的胚胎的存活的影响。 生存基于TTC测试。 三次重复中每一次测试大约100个胚胎
再培养
经如上所述去除PVS2后,在25℃连续光照条件下,将胚胎放在添加有2%蔗糖的固化的ND培养基上再培养。 在冷冻保存过程后(约8个月),小植物体适应了环境并且它们的根已覆盖有泥炭藓,将其种植在盆中,并转移至温室。
结果
基于两种不同的活力测试,使用胚胎预培养和通过玻璃化冷冻保存对TTC测试和体外再生长的存活率进行比较并暴露于LN 30分钟(图2)。 测试相关性很好。 因此,对于接下来的实验,存活的实验对象主要由TTC测试确定。在实验早期,将10日龄胚胎在添加有2%蔗糖(相当于0.06M蔗糖)的固化ND培养基上进一步培养3天,用缓冲液浸泡15分钟并从5分钟的时候开始用PVS2脱水处理直至5个小时,然后再放入液氮中。 只观察到15%的胚胎存活。 为了提高存活率,将10日龄胚胎在含有0.3,0.5或0.7M蔗糖的ND培养基上预培养3天。 将这些预培养的胚胎在25℃下用缓冲液浸泡15分钟,并在0℃不同的时间段下脱水后放入液氮中。如图3所示,从含有0.3M蔗糖的培养基上预培养的胚胎中观察到了最高的存活率,然后在0℃下用PVS2脱水3小时。 生存率达到60%。
图4再培养2周后的冷冻保存的胚胎(bar = 1 mm)
图5由通过玻璃化冷冻保存的8个月胚胎发育而来的已适应环境的苗木(bar = 5 cm)
在25℃下连续光照下,成功冷冻保存的胚胎在固化ND培养基上进行培养。 2周内在胚胎上观察到了绿色斑点(图4),随后从该胚胎发育成正常植株(图5)。
讨论
为了成功进行冷冻保存,必须避免在液氮快速冷却过程中发生致命的细胞内冷冻(Sakai和Yoshida 1967)。
因此,冷冻保存的细胞和组织必须经过充分的脱水,才能在浸入液氮之前发生玻璃化。 用于冷冻保存的玻璃化(玻璃形成)过程不需要对缓慢冷冻进行控制,并且通过直接转移到液氮中就能够冷冻保存细胞和分生组织(Fahy等人1984; Langis等人1989; Sakai等人1990)。在非常低的温度下(通过在室温或0℃下除去所有或大部分可冷冻的细胞水)玻璃化(通过高度浓缩的玻璃化溶液)取代了冷冻诱导的细胞脱水。 这一替代脱水过程对于有组织的宏观结构如分生组织和体细胞胚的成功冷冻保存是非常重要的,因为这些结构难以通过冷冻诱导脱水的方法均匀脱水(Withers和King 1979)。
根据报告,2.0M甘油和0.4M蔗糖的混合物在各种细胞和分生组织中的诱导脱水和冷冻耐受性非常的有效(Sakai等,1991a; Nishizawa等,1993; Matsumoto等,1994)。缓冲液有助于最大限度地减少严重脱水导致的有害膜变化。据报告,在高浓度糖的情况下的预培养对于提高冷冻保存细胞和分生组织的存活率是非常重要的(Uragami等1990; Niino和Sakai 1992; Niino 等,1992; Matsumoto等,1994)。 预培养增加脱水耐受性的确切机制尚不明确。预培养导致糖的积累(Uragami等,1990; Dereuddre等,1991),而且在严重脱水的条件下,可能能够增加膜的稳定性(Crowe等,1987)。
此次研究中,用2M甘油加0.4M蔗糖的混合物在25℃下覆盖在0.3M蔗糖预培养3天的胚胎上15分钟,然后在0℃下用PVS2溶液脱水3小时。 这些成功玻璃化和未缓冲的胚胎显示出高的存活率(约60%)并发育成正常的小植株。
在给定的暴露温度下,暴露时间对PVS2的影响与所切除的分生组织的大小有关并且似乎具有物种特异性(Niino等人,1992)。 在此次研究中,当在0℃下用PVS2溶液脱水3小时的时候,胚胎具有最高的存活率。当然,必须进一步的研究以优化该过程。
玻璃化方法已广泛应用于分生组织和毛状根(Niino等人1992; Matsumoto等人1995; Yoshimatsu等人1996)。
最近,已经证实了玻璃化并冷却至-196℃的芋头,香蕉和木瓜体细胞胚的分生组织能够产生高水平的枝条形成,而且预培养后的负荷治疗在诱导脱水耐受性以及这些热带材料于液氮中的深度冷却非常有效(Y. Takagi个人通讯)。 因此,这种玻璃化方法目前看起来是用于冷藏热带作物胚胎的很有前景的技术。
这里描述的低温程序不需要任何特殊的昂贵设备。 需要进一步研究以确认该低温方案对其他兰花胚胎的适用性。
参考文献
Crowe JH, Crowe LM, Carpenter JF, Wistrom CA (1987) Stabiliza-
tion of dry phospholipid bilayers and proteins by sugars. Bio-
chem J 242:1–10
Dereuddre J, Scottez C, Arnaud Y, Duron M (1990) Resistance of al-
ginate-coated axillary shoot tips of pear tree (Pyrus communis L.
Beurre Hardy) in vitro plantlets to dehydration and subsequent
freezing in liquid nitrogen: effect of previous cold hardening.
C R Acad Sci Paris Ser III 310:317–323
Dereuddre J, Blandin S, Hassen N (1991) Resistance of alginate-
coated somatic embryos of carrot (Daucus carota L.) to desicca-
tion and freezing in liquid nitrogen. 1. Effect of preculture. Cryo
Lett 12:125–134
Fabre J, Dereuddre J (1990) A new approach to cryopreservation of
Solanum shoot tips. Cryo Lett 11:413–426
Fahy GM, MacFarlane DR, Angell CA, Meryman HT (1984) Vitrifi-
cation as an approach to cryopreservation. Cryobiology 21:
407–426
Langis R, Schnable B, Earle ED, Steponkus PL (1989) Cryopreser-
vation of Brassica campestris L. cell sus
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 4 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[278960],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 纳米材料介导镉污染土壤原位修复的机理及研究进展外文翻译资料
- 纳米零价铁磁洗受镉污染水稻土壤的有效性验证外文翻译资料
- 镉对水稻叶片生长和养分运输的短期影响外文翻译资料
- 间接竞争ELISA的研制及可视化基于金纳米棒生长的多色酶联免疫吸附试验玉米赤霉烯酮的测定外文翻译资料
- 铅(Pb)诱导的小麦根系生化和超微结构变化外文翻译资料
- 用蚕豆根尖微核试验评估污水灌溉区和生物修复区土壤的遗传毒性外文翻译资料
- 镧在红土壤中的生物累积和其对玉米幼苗生长的影响外文翻译资料
- 铈对水稻幼苗生长及部分抗氧化代谢的影响外文翻译资料
- 用黄体孢子菌沉淀碳酸盐固定有毒金属的体外研究及其在含硫化物尾矿中的应用外文翻译资料
- 水牛妊娠早期生物标志物的编码序列克隆及部分序列密码优化后在大肠杆菌中的表达外文翻译资料


