
英语原文共 10 页,剩余内容已隐藏,支付完成后下载完整资料
利用自猝灭和去猝灭荧光探针实时检测和监测环介导扩增(LAMP)反应
1 摘要
环介导等温扩增(LAMP)是一种新型等温核酸扩增技术,具有操作简便、灵敏高、检测速度快的优势。而且反应不需要仪器和昂贵的试剂,在一些基层机构和现场检测被广泛应用。目前,LAMP的检测方法主要为依赖浊度检测和非特异性染料等间接检测方法,这往往会导致假阳性的产生。在本研究中,我们开发了一种直接检测方法,在环状扩增区域标记荧光探针,未结合状态时熄灭,仅与目的片段结合时发出荧光因此,这项技术被称为自猝灭/去猝灭探针LAMP检测方法(FLOS-LAMP)。它可以对LAMP扩增片段进行特异性检测。FLOS-LAMP检测方法已被广泛验证。在检测人类病原体水痘带状疱疹病毒中,FLOS-LAMP的检测限为500拷贝,临床敏感性和特异性分别为96.8%和100%。该技术具有很强的特异性,解决了LAMP技术易出现假阳性的缺点。同时FLOS-LAMP与其他LAMP引物组和不同的荧光团一起使用时,也展现出它的通用性和适应性。
关键词:环介导等温扩增(LAMP)、猝灭、特异性检测、环状引物荧光
2 前言
利用聚合酶链反应(PCR)进行现场诊断(POC)诊断所面临的挑战推动了基于等温原理的核酸扩增检测的发展,这些原理通常被称为iNAATrsquo;s。这些技术包括:链位移扩增(SDA),解旋酶依赖扩增(HDA),重组酶聚合酶扩增(RPA)和环介导扩增(LAMP)。iNAAT与PCR相比,它的一个优点是可以在恒温条件下扩增目的片段,从而避免了两步或三步PCR所需热循环步骤。由于不进行热循环步骤,iNAAT反应非常快(5-20分钟),因此与传统PCR相比,“样品到答案”的时间更短。由于不需要热循环,扩增反应可以使用简单的仪器进行,例如传统的水浴锅,大大降低了设备成本。这一特点使得等温扩增系统在在基层机构和现场检测有很大优势。
在iNAAT中,LAMP技术在实验室和现场诊断被广泛的应用。这种体外扩增技术在60-65°C的恒温反应条件下,将少量目标分子扩增到109-1010个拷贝。由于LAMP反应扩增时间短(10-15分钟),扩增产率高(gt;10micro;g)。因此具有很高的灵敏度。在大多数情况下其检测灵敏度超过实时定量PCR (qPCR)—大多数分子诊断分析中最常见的“金标准”技术。LAMP反应主要由四条引物组成,即FIP(正向内引物)、BIP(反向内引物)、F3(正向引物)和B3(反向引物)识别目标序列的六个不同区域。在LAMP反应中也可加入两对环引物LF(正向环引物)和LB(反向环引物),来提高反应速度。这个修改称为“加速LAMP”,是后来对经典的四引物LAMP的修改。LF/LB引物通过为自动循环的FIP/BIP引物创造额外的结合位点来加速四个引物的LAMP反应。这种自动循环可以形成“花椰菜式”DNA结构,这种结构本质上是DNA串联体,在交替的反向重复序列之间穿插着环状结构。
通常,LAMP检测为终点检测。它需要对扩增后的产物进行测定,所以可能导致交叉污染或非特异性扩增。常见方法包括:解决放大产品在琼脂糖凝胶电泳检测扩增产物,,利用浊度仪检测LAMP反应中焦磷酸镁的沉淀,在紫外光下检测dsDNA,如SYBRGreenI或EvaGreen以及添加金属离子指示剂。如钙黄绿素/ Mn 2 和HNB染料。其中,插入荧光染料被用于临床诊断,因为它们对蛋白质等不透明物质更敏感和相对耐受,而这些物质会影响浊度信号。然而,非特异性检测方法的一个主要缺点是容易产生假阳性。尽管LAMP由4-6个不同的引物独立识别靶序列上的6-8个独立区域,在理论上比PCR具有更高的特异性。虽然非特异性扩增的机制尚不清楚,但有推测认为这可能是6个引物相互作用导致的。因此,间接检测扩增产物仍然是LAMP的主要缺点之一。
能以序列依赖的方式特异性地与瞬时产生的单链DNA结构杂交的荧光标记的核酸已被证明是任何非特异性的,基于染料的检测系统的理想解决方案。这方面的例子包括专门为qPCR开发的基于水解的TaqMaTM探针和许多其他的分子信标。由于iNAAT和LAMP本身的非典型扩增化学,这些专门为qPCR开发的探针技术的无缝应用已被证明是技术上的挑战。然而,人们已经尝试开发一种基于探针的LAMP检测系统,包括:信号丢失鸟嘌呤猝灭、使用标记引物获得信号荧光、通过释放猝灭(DARQ)检测扩增、同化探针、一步抓住(OSD)报告器,以及最近的分子信标
本文献展示了使用自猝灭荧光探针作为实时检测和监测LAMP反应的替代方法。这些探针最初是作为发光延伸技术的一部分进行开发的,测试了它们对实时检测LAMP反应产物的适用性。这种新型的实时荧光LAMP技术,即自灭LAMP上的环状引物荧光(FLOS-LAMP),可用于检测临床上重要的人类病原体水痘带状疱疹病毒(VZV)。
优选的试验目标病毒VZV是水痘和带状疱疹的病原体,无论是免疫能力强的还是免疫功能低下的个体,常导致中枢神经系统表现和肺炎。这些疱疹病毒感染并建立终身潜伏期,随后从人类感觉神经元神经节重新激活。无论是从治疗角度还是从感染控制角度来看,其快速、早期发现对有症状的患者都非常重要。由于其独特的信号发生机制,即仅在靶标存在时才产生荧光,因此所提出的LAMP方法大大提高了我们在实际临床样本中特异性检测VZV的能力。
3 方法
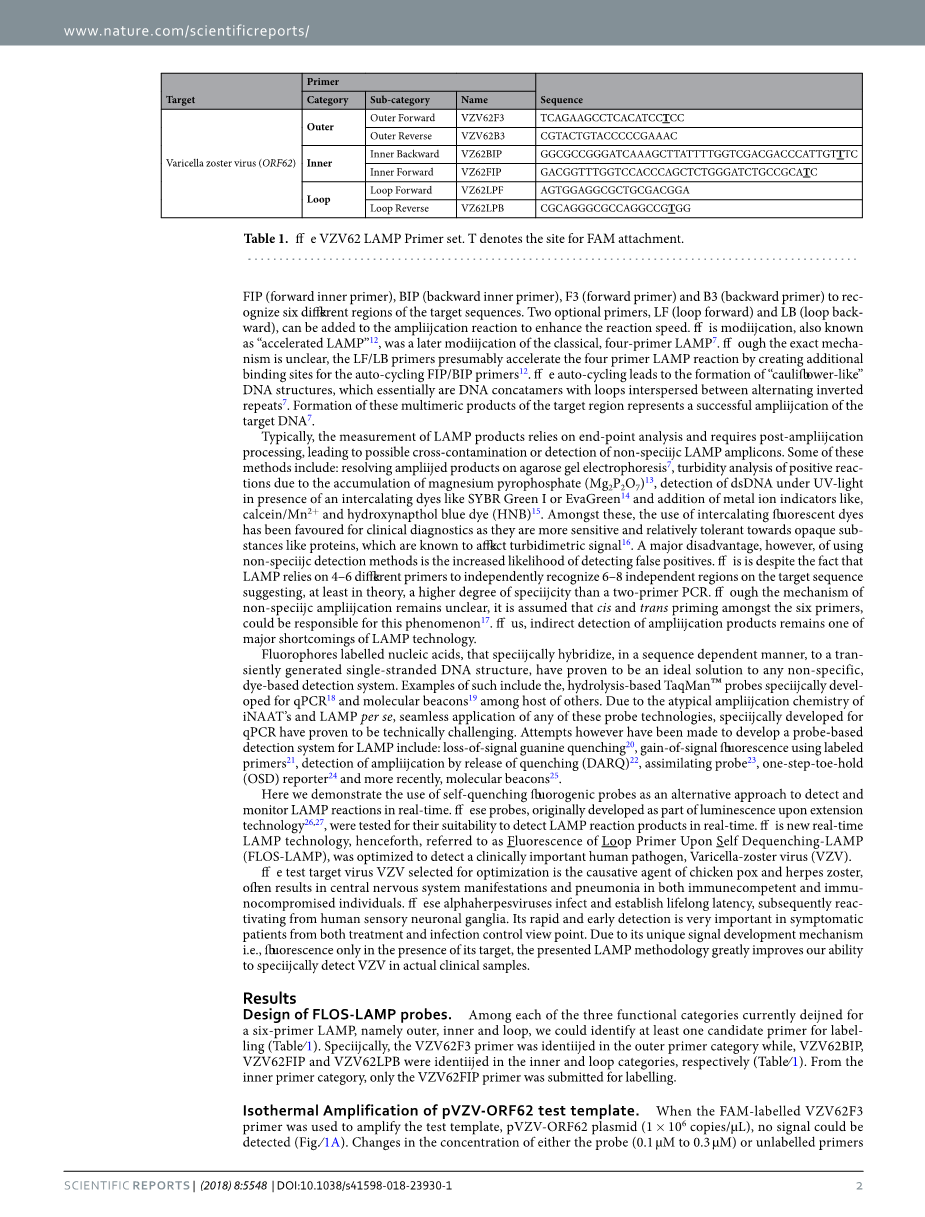
3.1 FLOS-LAMP探针的设计
FLOS-LAMP探针的设计方法是用荧光团标记每个LAMP引物(F3、B3、FIP、BIP、LPB和LPF)的内部胸腺嘧啶(T)残基。确定确切的T残留的荧光团可以附加有效淬火/ de-quenching以下标签criteria26, 27日使用:(1)的胞嘧啶(C)和鸟嘌呤(G)残留在三号航站楼的结束,(2)T残留在第二或第三位置从这3 端,和(3)一个或多个G核苷酸侧翼T残渣(可选)。最初的假设检验和随后的开发/优化研究集中在单一LAMP引物组,即“VZV62”(表1),该引物此前被设计为特异性扩增水痘带状疱疹病毒ORF62基因38。在本研究结果的基础上,开发了用于巨细胞病毒(CMV)基因UL5439(见附表S1)、单纯疱疹病毒(HSV)-1基因US440(见附表S2)和克隆载体pUC19(内部设计;参见补充表S3)。VZV62、CMV-UL54和HSV1-US4 LAMP引物使用常用荧光团荧光素(FAM)标记,pUC19 LAMP引物使用荧光团JOE(6-羧基-4 ,5 -二氯-2 ,7 -二甲氧基荧光素)分别标记。荧光团通过一个6碳的间隔臂连接在T残基上,位于环的5号位置。FLOS-LAMP探针可从IDT (Coralville, IA)或biobbasic公司(Markham, ON)定制(HPLC纯化级)。
3.2 目标DNA模板
通过IDT (Coralville, IA)的Minigene质粒(plasmid (Minigene))测序,获得了VZV62 LAMP的目标基因ORF62 gene38。将DNA质粒(pVZV-ORF62)溶解于TE缓冲液中,工作浓度为1 times; 106 copies/micro;L。以普通克隆载体pUC19为标准模板,浓度为1 times; 106拷贝/micro;L。采用gBlocktrade;(IDT)格式自定义合成了HSV1 US4 gene40的线性双链DNA片段,作为HSV1-US4 LAMP引物(1 times; 106 copies/micro;L)的靶标。
3.3 FLOS-LAMP反应条件及检测
FLOS-LAMP反应(共20micro;L)包含12micro;L的iso - 004等温大师混合(Optigene,英国霍舍姆)包含Geobacillus物种DNA聚合酶(2.0 GspSSD LF),耐热性的无机焦磷酸酶,优化缓冲区(包括MgCl2核苷酸和其他专用添加剂),3micro;L探针/探针混合物和5micro;L的DNA模板。在某些实验中,还使用了加色剂(ISO-004),它含有一种专有的双链DNA插入染料。LAMP检测在实时荧光仪ESEQuant TS2.6 (Qiagen GmbH, Lake Constance, Germany)上进行,在制造商(Optigene)推荐的最佳时间和温度65℃下进行20分钟。对仪器进行编程,每30秒采集一次荧光信号。当任何信号达到斜率值,距基线(0 mV) gt;20 mV时,用ESEQuant TS2 studio软件ver 1.17.0 (Qiagen)软件标记为阳性扩增。时间到正(Tp)值(分钟)是将x轴刻度上的数值(指定为时间[30秒间隔])除以2得到的。
3.4 临床样本
以前通过qPCR41检测VZV阳性的临床样本(Cq lt; 40 =阳性;Cqge;40 =阴性;见补充表S4)或商业直接荧光测定(DFA;SimFluor;光诊断trade;;用EMD Millipore)验证优化后的VZV62 FLOS-LAMP扩增性能。这些在minus;80°C保存的回顾性残留样品之前提交给BC儿童医院微生物与病毒学实验室。这些样品保存在原始的通用传输介质(UTM;科潘诊断公司(Copan Diagnostics, Murrieta, CA)。为了保持患者的匿名性,每个样本都进行了编码,并删除了所有的患者标识符,以确保参与本研究的人员不知道任何患者信息。由于该研究仅涉及二次使用匿名人体生物材料,因此免除了英属哥伦比亚大学研究伦理委员会的审查。使用InstaGenetrade;基质(Bio-Rad Laboratories, Hercules, CA)提取DNA如下:等体积的样品(50micro;L)和InstaGenetrade;基质(50micro;L)短暂涡流,并在95°C加热10分钟。5micro;L的提取液直接用于LAMP。非目标微生物包括临床标本(n = 32),对HSV-1和-2、巨细胞病毒、eb病毒、呼吸道合胞病毒、副流感病毒、百日咳杆菌和肺炎支原体检测呈阳性(表5)。样本类型不同,包括鼻咽(NP)/口咽(OP)拭子、支气管肺泡灌洗液(BAL)、尿液、唾液和鼻腔清洗。两种商业标准,纯化的人类基因组DNA和CMV WHO标准,也被纳入非靶面板(见补充表S5)。18例既往经qPCR检测VZV阴性的临床样本也采用VZV62 FLOS-LAMP法检测。
3.5 检测灵敏度分析
将标准pVZV-ORF62质粒(1 times; 106 copies/micro;L)在TE缓冲液中连续稀释10倍,VZV62 flos lamp用5micro;L进行检测,以确定检测限。染料基础的检测也并行进行,使用同一mastermix的插层染料版本(ISO-004),用于VZV62 flosLAMP。对VZV62 FLOS和插层染料检测方法进行三次检测。
4 结果
4.1 FLOS-LAMP探针的设计
在每个定义的三个功能类别目前six-primerLAMP,即外部、内部和循环,我们可以确定至少一个候选引物标签(表1)。具体来说,外探针类别中的VZV62F3探针被确认,VZV62BIP, VZV62FIP和VZV62LPB内在和循环中标识类别,分别从内部引物(表1)。类别,只有VZV62FIP探针提交标签。
4.2 pVZV-ORF62试验模板的等温扩增
用 fam 标记的 vzv62f3引物扩增 pvzv-orf62质粒(1106拷贝/l) ,未检测到信号(图1a)。无论是探针(0.1 m ー0.3 m)还是无标记引物(vzv62f3/vzv62b3/vzv62fip/vzv62bip/vzv62bpf)的浓度变化都没有改变这一阴性结果。而当VZV62FIP-FAM探针(0.2micro;M)与相同的质粒模板(pVZV-ORF62: 1 times; 106 copies/micro;L)使用时,得到阳性扩增曲线(Tp = 9.5 min)(图1A)。该探针/引物组合的水控没有导致任何高于基线的荧光(信号lt;0 mV),说明观察到的阳性信号是由于VZV62FIP-FAM探针掺入了反应产物。对于使用的VZV62FIP-FAM探针的浓度(0.2micro;M),放大信号的最大强度在200至250 mV之间变化(图1A)。将VZV62FIP-FAM探针的浓度增加到0.3micro;M和操作其他未标记的引物,都不会改变Tp(变化9-9.5 min)或荧光信号的振幅(200 - 250 mV)。有趣的是,当使用标记的VZV62LPB-FAM(0.2micro;M)探针时,在相似的模板输入条件(pVZV-ORF62: 1 times; 106 copies/micro;L)下,信号幅值比VZV62FIP-FAM探针(200 ~ 250 mV)高出4倍(1000 ~ 1100 mV)。由于VZV62LPB-FAM获得的信号幅值较高,因此对该探针进行了进一步的优化。
(A)将外部(VZV62F3)、内部(VZV62FIP)和环路(VZV62LPB)引物转化为dT-FAM荧光探针后得到的信号谱图。输入模板浓度pVZV-ORF62质粒:1 times; 106 copies/micro;L。(B)荧光信号强度因基料水平的变化而变化,范围为0.5X、1.0X、1.5X、2.0X和2.5X。输入模板浓度pVZV-ORF62质粒:1 times; 106 copies/micro;L。以水为阴性对照。每次[30秒间隔]单元(x轴)在等温仪器上代表30秒。
4.3 基本混合料
Vzv62lpb-fam 探针(0.2 m)所用的无标记引物的浓度用“混合碱”(表2)确定。这个引物浓度范围是由生产厂家(optigene)为基于染料的 iso-00
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[264356],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 豆根瘤菌半乳糖醇2-脱氢酶的研究、表征及其在d-塔格糖生产的应用外文翻译资料
- 重组蔗糖磷酸化酶的表达及性质研究外文翻译资料
- 全麦面包与白麦面包相比,其糊化、水解和消化率降低外文翻译资料
- 重组贻贝粘附蛋白fp-3体粘附强度的比较研究外文翻译资料
- 由解淀粉芽孢杆菌产生的杆菌霉素D与植物病原真菌禾谷镰孢镰刀菌拮抗相互作用外文翻译资料
- κ-卡拉胶及其寡糖在冷冻贮藏过程中能保持虾泥(虾滑)肌原纤维蛋白的理化性质外文翻译资料
- 纤维素纳米晶体增强草莓胶保存的阿拉伯树胶基纳米复合薄膜的开发外文翻译资料
- 改善地衣芽孢杆菌中甘油的分解代谢,以生产聚γ-谷氨酸外文翻译资料
- 通过在工程化谷氨酸棒杆菌S9114中系统操作L-ornithine代谢来提高L-ornithine产量外文翻译资料
- 工程菌Halomonas hydrothermalis Y2在低盐度的培养基中高产 四氢嘧啶外文翻译资料


