
英语原文共 5 页,剩余内容已隐藏,支付完成后下载完整资料
基于二氧化锰的纳米制剂同时发生的类芬顿离子传递和谷胱甘肽的消耗对化学动力疗法有加强作用
Li-Sen Lin , Jibin Song , Liang Song, Kaimei Ke, Yijing Liz, Zijian Zhou, Zheyu Shen, Juan Li, Zhen Yang, Wei Tang, Gang Niu, Huang-Hao Yang,*and Xiaoyuan Chen*
摘要:化学动力疗法(CDT)利用铁包体化的芬顿化学作用通过转换内源性的过氧化氢成为高毒性羟基自由基(bull;OH)来摧毁肿瘤细胞。缺乏类芬顿金属基的化学动力学试剂,细胞内带羟基的谷胱甘肽(还原型谷胱甘肽)的清除能力大大减弱了化学动力学功效。据报道一种自我强化的基于二氧化锰的化学动力学纳米制剂有类芬顿锰离子传递和谷胱甘肽消耗作用。在生理介质富含碳酸氢根离子的作用下,锰离子发挥类芬顿作用以从过氧化氢生产羟基。通过癌症细胞吸收二氧化锰镀膜的介孔二氧化硅纳米粒子(介孔二氧化硅包裹二氧化锰纳米颗粒)时,二氧化锰壳层经历了一个还原型谷胱甘肽消耗而形成谷胱甘肽硫化物和锰离子的氧化还原反应,这导致了还原型谷胱甘肽消耗增强的化学动力学疗法。这和还原型谷胱甘肽激活的核磁共振对比效应和二氧化锰的分解使介孔二氧化硅包裹二氧化锰纳米颗粒能实现核磁共振检测的化学-化学动力学联合疗法。
活性氧(ROS),包含超氧阴离子,过氧化氢(H2O2),单线态氢和羟基(bull;OH),具有通过生物分子如脂质,蛋白质和DNA来杀死癌细胞的能力。【1】近年来,科学家们花了大量精力在发展基于活性氧治疗癌症的方法,尤其是化学动力疗法(CDT),这一疗法用铁介导的芬顿反应将化学反应低的过氧化氢转化为羟基(危害最大的ROS【2】)来诱导细胞内氧化应激反应。重要的是,癌症细胞内过量分泌过氧化氢,作为肿瘤化学动力疗法的内源性前药。【3】至今为止,几种载铁纳米粒子(NPs)通过内源性的基于过氧化氢的芬顿反应用作化学动力疗法试剂来触发细胞内铁死亡。【2a,4】尽管一些其他的金属离子包括锰离子,
Dr. L.-S. Lin,[ ] Dr. J. Song,[ ] L. Song, K. Ke, J. Li, Prof. H.-H. Yang教育部食品安全与生物学分析科学重点实验室, 福州大学化学学院 福州350108 (中国)
电子邮箱: hhyang@fzu.edu.cn
Dr. L.-S. Lin,[ ] Dr. J. Song,[ ] Dr. Y. Liu, Dr. Z. Zhou, Dr. Z. Shen, Dr. Z. Yang, Dr. W. Tang, Dr. G. Niu, Dr. X. Chen 分子影像与纳米医学实验室(LOMIN), 国立生物医学影像与生物工程研究所 (NIBIB), 国立卫生研究院 (NIH) 贝塞斯达, MD 20892 (美国)
电子邮箱: shawn.chen@nih.gov
[ ] 这些作者对这项工作贡献相等.
这些作者的信息和ORCID号可以在以下位置找到:https://doi.org/10.1002/anie.201712027.
钴离子和铜离子也显示类芬顿活性,【5】还有基于化学动力学纳米剂的类芬顿金属构造的研究很少。此外,类芬顿金属释放的实时影像对监测化学动力疗法过程很重要。
可以想象的是,在癌症细胞内过量表达的谷胱甘肽(还原型谷胱甘肽)可能是化学动力疗法中最具挑战的困难之一。【6】还原型谷胱甘肽在保护细胞抵御各种伤害性试剂时扮演重要角色;【7】但是,癌症细胞内还原型谷胱甘肽水平升高也显示可以增加对化学,放射学和光动力学疗法的抵抗力。【8】作为一个已知的细胞内抗氧化剂,还原型谷胱甘肽展现了强有力的清除由化学动力剂产生高活性羟基的能力,从而大大提高癌症细胞对氧化应激的抵抗并减小化学动力疗法的功效。因此,细胞内还原型谷胱甘肽水平的减少对化学动力疗法纳米药物规避肿瘤抗性和提高化学动力效率非常需要。
在此,我们第一次展示了二氧化锰(MnO2)同时拥有类芬顿锰离子传递和消耗还原型谷胱甘肽作用,它可以作为一种智能的同时破坏细胞抗氧化防御系统(ADS)和传递羟基发生器进入细胞内的化学动力疗法试剂以(方案1a)以达到增强化学动力疗法的目的。通过过量的高锰酸盐反应硫醇基团在硫醇官能化介孔二氧化硅(MS)纳米颗粒的表面原位形成二氧化锰,这导致形成的二氧化锰包裹介孔二氧化硅纳米颗粒(介孔二氧化硅包裹二氧化锰纳米颗粒)可被用作核磁共振成像(MRI)监测化学-化学动力联合疗法(方案1b)。二氧化锰壳层可以与还原型谷胱甘肽发生氧化还原反应产生锰离子和氧化型谷胱甘肽(GSSG)。【9】值得注意的是碳酸氢盐(HCO3-)是锰离子介导的类芬顿反应。【5a】幸运的是,碳酸氢根/二氧化碳(CO2)作为最重要的生理缓冲液之一,能提供足够的碳酸氢根来支持锰离子触发过氧化氢产生羟基。在癌症细胞介孔二氧化硅包裹二氧化锰纳米颗粒内部化后,二氧化锰壳层将释放具有良好类芬顿活性的锰离子来将线粒体产生的内源性过氧化氢转换成剧毒性的羟基同时消耗细胞内的抗氧剂还原型谷胱甘肽以防止羟基的清除,从而使得肿瘤化学动力学疗法得以增强,这是因为还原型谷胱甘肽消耗所致抗氧化防御机制损坏使癌症细胞对锰离子所致的氧化应激更敏感。与此同时,还原型谷胱甘肽反应解离的二氧化锰壳层使其可以用作控制二氧化硅介导的纳米颗粒药物释放的守门员。与二氧化锰相比,锰离子的纵向(T1)弛豫率明显更高,这赋予二氧化锰壳层以还原型谷
方案1. a)二氧化锰作为一种加强癌症化学动力疗法的智能化学动力剂的机制。在内吞后,二氧化锰能和细胞内还原型谷胱甘肽反应生成氧化型谷胱甘肽和锰离子,这发挥了出色类芬顿效应以在生理碳酸氢根存在条件下从内源性过氧化氢产生高活性高的羟基。还原型谷胱甘肽消耗导致的抗氧化防御系统的损害使得癌症细胞对从锰离子媒介的类芬顿过程形成的羟基更敏感,这增强了化学动力疗法。b)介孔二氧化硅包裹二氧化锰纳米颗粒在核磁影像监测的化学-化学动力联合疗法中运用的图示。
胱甘肽激活的核磁共振影像对比作用,这可以被用来监测
二氧化锰和还原型谷胱甘肽的反应以及紧跟着发生的化学-化学动力治疗过程。
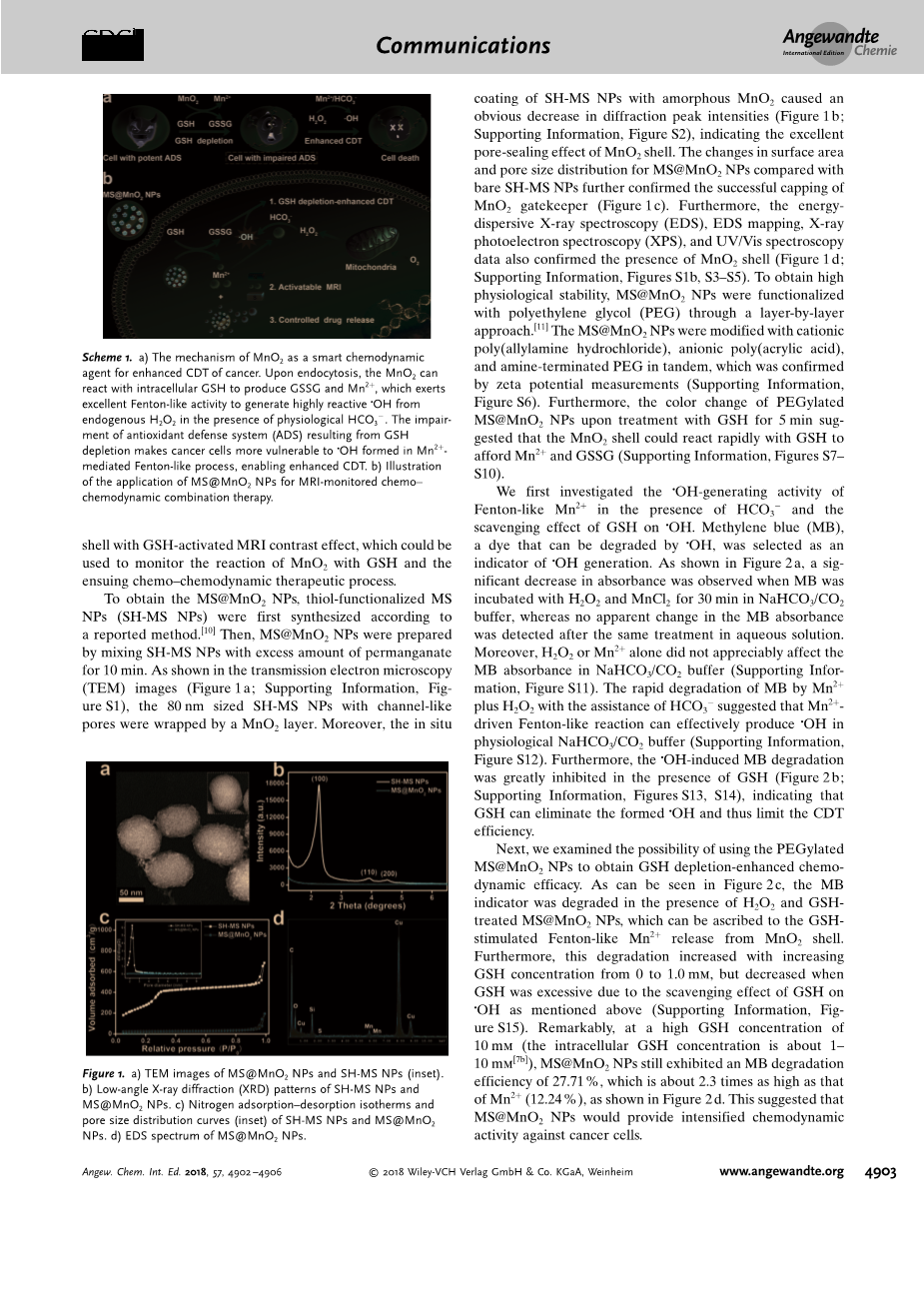
为了获取介孔二氧化硅包裹二氧化锰纳米颗粒,硫醇官能化介孔二氧化硅纳米颗粒(SH-MS NPs)通过一种被报道的方法【10】合成。然后,介孔二氧化硅包裹二氧化锰纳米颗粒通过将硫醇官能化介孔二氧化硅纳米颗粒与过量高锰酸盐混合十分钟被首次合成。如透射电子显微镜(TEM)图像所示(图 1a;支撑信息,图S1),具有类通道孔的80nm粒径的硫醇官能化介孔二氧化硅纳米颗粒被二氧化锰层包裹。而且,非晶形二氧化锰包裹的硫醇
图1.a)介孔二氧化硅包裹二氧化锰纳米颗粒和硫醇官能化介孔二氧化硅纳米颗粒(插图)的透视电子显微镜图像。b)硫醇官能化介孔二氧化硅纳米颗粒和介孔二氧化硅包裹二氧化锰纳米颗粒的低角度X-射线衍射(XRD)图谱。c)硫醇官能化介孔二氧化硅纳米颗粒和介孔二氧化硅包裹二氧化锰纳米颗粒氮吸附-解吸等温线和孔径分布曲线(插图)。d)介孔二氧化硅包裹二氧化锰纳米颗粒的电镜能谱。
官能化介孔二氧化硅纳米颗粒致使一个明显的衍射峰强度(图1b;支撑信息,图S2)下降,这表明二氧化锰壳层完美的气孔密封作用。表面积和介孔二氧化硅包裹二氧化锰纳米颗粒的孔径尺寸分布变化与裸露的硫醇官能化介孔二氧化硅纳米颗粒的比较进一步证实了二氧化锰守门人的成功封顶(图1c)。此外,能量色散X-射线光谱(EDS),EDS映射,X-射线光电子能谱(XPS),和紫外/可见吸收光谱数据也证实了二氧化锰壳层(图1d;支撑信息,图S1b,S3-S5)的存在。为获取高生理稳定性,介孔二氧化硅包裹二氧化锰纳米颗粒通过一层一层的聚乙二醇(PEG)被功能化。【11】介孔二氧化硅包裹二氧化锰纳米颗粒被阳离子多聚体(盐酸烯丙胺)修饰,阴离子多聚体(丙烯酸),和胺端基的聚乙二醇串联,这被zeta电位测度证实(支撑信息,图S6)。此外,用还原型谷胱甘肽处理聚乙二醇化的介孔二氧化硅包裹二氧化锰纳米颗粒5分钟后的颜色变化显示二氧化锰壳层可以和还原型谷胱甘肽快速反应从而提供锰离子和氧化型谷胱甘肽(支撑信息,图S7-S10)。
我们首先研究了在碳酸氢根存在下类芬顿型锰离子产生羟基的反应和还原型谷胱甘肽对羟基的消除作用。亚甲基蓝(MB),一种可以被羟基降解的染料,它被选作羟基生成的指示剂。如图2a显示,当亚甲基蓝与过氧化氢和氯化锰在碳酸氢钠/二氧化碳缓冲液中培养30分钟被吸光度显著下降,而亚甲基蓝在水溶液中以相同方法处理后吸光度没有明显变化。此外,过氧化氢或者锰离子单独使用不会明显影响亚甲基蓝在碳酸氢钠/二氧化碳缓冲液中(支撑信息,图S11)的吸光度。亚甲基蓝在锰离子和过氧化氢加上碳酸氢根存在下的快速降解说明了锰离子驱动的类芬顿反应可以在生理性碳酸氢钠/二氧化碳缓冲液条件下(支撑信息,图S12)有效产生羟基。此外,羟基诱导亚甲基蓝的降解在还原型谷胱甘肽(图2b;支撑信息,图S13,S14)存在下大大抑制,这说明还原型谷胱甘肽可以消除形成的羟基,从而限制化学动力学疗法的效率。
接下来,我们测试用聚乙二醇修饰的介孔二氧化硅包裹二氧化锰纳米颗粒来达到增强还原型谷胱甘肽消耗的化学动力效率的可能性。如图2c所示,亚甲基蓝指示剂在过氧化氢和还原型谷胱甘肽处理的介孔二氧化硅包裹二氧化锰纳米颗粒存在下被降解,这可以归因于还原型谷胱甘肽刺激的类芬顿锰离子从二氧化锰壳层中释放。此外,这种降解同还原型谷胱甘肽浓度从0到1.0mM上升而上升,但是如上文提到的(支撑信息,图S15)当还原型谷胱甘肽由于还原型谷胱甘肽对羟基的消除作用过剩时下降。值得一提的是,在还原型谷胱甘肽10mM的高浓度时(细胞内还原型谷胱甘肽浓度大约在1-10mM【7b】),介孔二氧化硅包裹二氧化锰纳米颗粒仍显示亚甲基蓝降解效率为27.71%,这高达锰离子(12.24%)的2.3倍,如图2d所示。这表明介孔二氧化硅包裹二氧化锰纳米颗粒可以达到增强化学动力反应对癌症细胞的作用。
图2.a)紫外/可见吸收光谱和亚甲基蓝在不同溶液锰离子介导的类芬顿反应中降解图片(插图)。b)亚甲基蓝在是否存在还原型谷胱甘肽情况下锰离子介导的类芬顿反应的降解。c)亚甲基蓝被过氧化氢加还原型谷胱甘肽处理的介孔二氧化硅包裹谷胱甘肽纳米粒子的降解。d)条形图显示亚甲基蓝被过氧化氢加锰离子或者介孔二氧化硅包裹二氧化锰纳米颗粒在10nM还原型谷胱甘肽的存在下吸收降解比例。在(b)-(d)中:反应缓冲液为25mM碳酸氢钠/5%二氧化碳,【锰】=0.5mM,【过氧化氢】=8mM。e)介孔二氧化硅包裹二氧化锰纳米颗粒在有无1mM还原型谷胱甘肽情况下的r1值。f)从还原型谷胱甘肽处理的介孔二氧化硅包裹二氧化锰纳米颗粒的抗癌药物喜树碱的释放曲线。
为了评估激活的还原型谷胱甘肽核磁共振影像对比聚乙二醇修饰的介孔二氧化硅包裹二氧化锰纳米颗粒的表现,我们比较了还原型谷胱甘肽治疗前后的纵向弛豫率。如图2e所示,聚乙二醇修饰的介孔二氧化硅包裹二氧化锰纳米颗粒在还原型谷胱甘肽加入后的纵向弛豫率升高了12.8倍,这表明介孔二氧化硅包裹二氧化锰纳米颗粒将是一种潜在的用于癌症对还原型谷胱甘肽反应的纵向弛豫率对比图像的试剂。介孔二氧化硅包裹二氧化锰纳米颗粒相对低的r1值与释放的锰离子相比主要是由于锰原子在介孔二氧化硅包裹二氧化锰纳米颗粒的化学交换且质子被明显抑制。【12】
为了证实二氧化锰壳层作为控制药物释放的守门员的可能性,疏水性抗癌药物喜树碱(CPT)被选作模型并在还原型谷胱甘肽存在下被装填到介孔二氧化硅包裹二氧化锰纳米颗粒(MS@MnO2-CPT) ,这显示了守门员二氧化锰的堵塞孔作用。相反的,持续的喜树碱释放在还原型谷胱甘肽加入后被观测到,这是由于二氧化锰壳层被还原型谷胱甘肽去除(支撑信息,图S16)。此外,随着还原型谷胱甘肽浓度上升释放率增加。这些结果表明介孔二氧化硅包裹二氧化锰纳米颗粒可以被用作药物运输控制系统。
为了测试还原型谷胱甘肽消除可以使肿瘤细胞对化学动力疗法试剂敏感。我们评估了锰离子在是否存在L-丁硫氨酸亚砜胺(L-BSO)情况下的细胞毒性,一种还原型谷胱甘肽合成抑制剂。【8b】首先,锰离子在体外化学动力学作用下用2rsquo;,7rsquo;-二氯荧光乙酰乙酸盐(DCFH-DA)作为氧化应激的探针。在扩散进细胞后,2rsquo;,7rsquo;-二氯荧光乙酰乙酸盐被细胞内脂酶脱去乙酰基成为非荧光2rsquo;,7rsquo;-二氯荧光素(DCFH),这可以被氧化成荧光2rsquo;,7rsquo;-二氯荧光素(DCF)。【13】正如预期,锰离子暴露的U87MG人神经胶质瘤细胞对控制细胞显示了更强的2rsquo;,7rsquo;-二氯荧光素荧光性(支撑信息,图S17),这表明暴露于氯化锰条件下细胞的氧化应激反应,这可以归因于内源性由类芬顿锰离子参与的过氧化氢转化为高反应活性的羟基。此外,锰离子显示一种依赖剂量和时间的对细胞U87MG的毒性(支撑信息,图S8)。值得注意的是,细胞U87MG与氯化锰一起培养的生存能力和非毒剂量的2rsquo;,7rsquo;-二氯荧光乙酰乙酸盐相比后者比前者明显低,如图3a所示,这表明
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[245860],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 下游产品是硫酸乙酰肝素2-0-磺基转移酶的有效抑制剂外文翻译资料
- 奥希替尼的耐药性不断发展的格局外文翻译资料
- 伪五山淫羊隆区域特异性鼠李糖基转移酶催化丙烯醇的3-阿霉素酰化 反应外文翻译资料
- 标记化合物和放射性药物杂志外文翻译资料
- 脂肪酶大规模分离水飞蓟宾非对映异构体外文翻译资料
- 钯催化萘胺与二芳基二硫化物和二硒醚的 C-H键裂解近选择性加成反应外文翻译资料
- 铜催化,定向基团辅助氟化芳烃和异芳烃碳氢键外文翻译资料
- Talin1通过局灶性粘附信号和失巢凋亡抵抗促进肿瘤侵袭和转移。外文翻译资料
- 杜氏肌营养不良综合征中的外显子跳跃外文翻译资料
- 来源于红树林内生菌稀有的细菌产caryolanes类代谢产物Bacaryolanes A−C外文翻译资料


