
英语原文共 9 页,剩余内容已隐藏,支付完成后下载完整资料
酶驱动运动
Xi Zhao, Kayla Gentile, Farzad Mohajerani, and Ayusman Sen
概论:酶在生命系统中无处不在。除了传统的运动蛋白外,酶的功能被认为仅限于促进生化反应。最近的研究表明,游离的游泳酶在催化反应时,会产生足够的机械力来产生它们自己的运动,通常被观察到的是依赖于基质聚集的增强扩散。最初迹象表明,每次底物翻转产生的冲力与运动蛋白产生的力相当,并且在激活细胞机械传感的生物吸附分子的范围内,使酶催化产生的力成为一种新的力生物学的例子。此外,当存在于底物浓度的梯度时,酶会沿着梯度上升:这是分子水平趋化的一个例子。分子趋化的驱动力似乎是由于有利的酶底物相互作用而降低化学势,我们认为趋药性是通过引导催化剂和底物相互运动来促进酶催化。
作为反应级联的一部分的酶被证明是通过连续趋药性来组装的;每一种酶都有其特定的底物梯度,而这又由前面的酶反应产生。因此,催化级联中的顺序趋药性有时间依赖性、特定催化剂的自组装性。这是信息如何从化学梯度中产生的一个例子,很容易让人认为类似的机制是生命系统组织的基础。在实践层面上,趋化作用可用于分离活性较低或活性较低的催化剂,并因此具有广泛的适用性。当连接到更大的粒子上时,酶就像发动机一样,赋予粒子运动性,并在底物梯度方向上移动它们。酶催化产生的冲力也可以传递到周围的流体、分子和胶体示踪剂,从而产生对流流体泵送和增强示踪剂扩散。直接输送液体的酶驱动泵可以通过将酶固定在固体载体和提供的基质上来制备。因此,酶泵构成了一个新的平台,将传感和微流体泵结合到一个自驱动的微设备上。从整体上看,活性酶产生的力 在纳米机械、纳米尺度的自组装、货物运输、药物输送、微纳米流体和化学/生化传感等方面都有潜在应用。我们也假设,在体内酶可能负责细胞质的随机运动,组织代谢物和标记复合物,以及细胞内液体的对流运输。通过对酶如何将化学能转化为定向机械力的详细了解,我们可以了解生物和仿生分子的制备、开发和监测的基本原理。
介绍:
通过将化学能转化为机械能,生命体中的生物发动机能够在精确的时间和空间上执行任务1-3。像激酶和动力蛋白这样的连续运动沿着微管运输货物,像肌球蛋白II这样的非连续运动收缩肌动蛋白丝4,5。然而,通过化学催化产生的力并不仅限于传统的运动蛋白;各种各样的自运动的酶已被证明可以将化学能转化为机械能。此外,“信封背后”的计算表明,生成的冲力/底物翻转(约10 pN)对这些酶与观察马达蛋白,提高了运动蛋白是由游离酶进化而来的可能性,自然界将它们“跟踪”起来,以允许在布朗随机化的情况下进行定向运动,
本文综述了自由游动酶催化力产生的证据,讨论了这种现象可能产生的应用,并对酶促力在生物学中的作用进行了推测。
增强酶的扩散
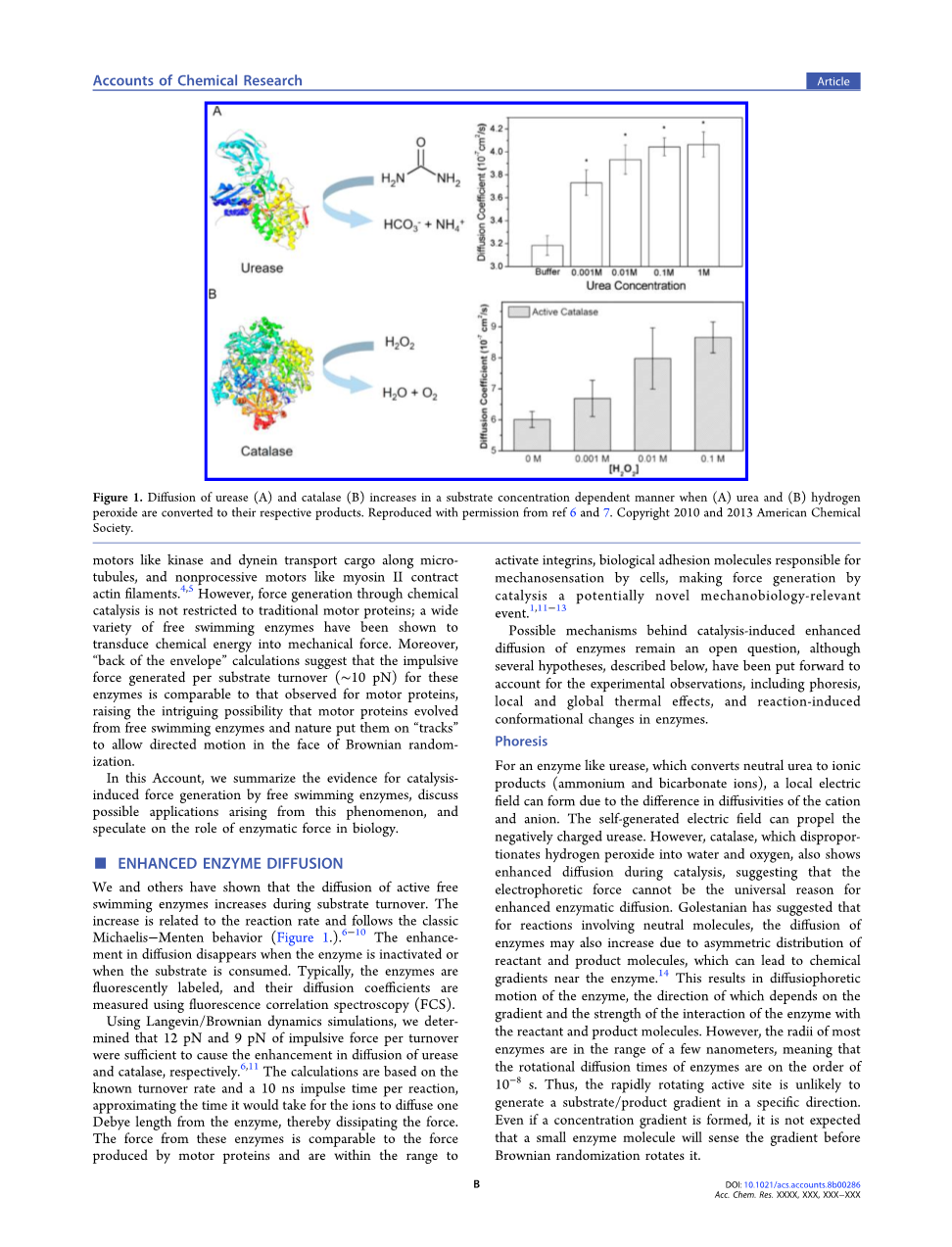
我们和其他人已经证明,在底物翻转过程中,活性游离酶的扩散增加。这种增加与反应速率有关,遵循经典的Michaelisminus;Menten行为(图1)6-10。当酶失活或底物被消耗时,扩散的增强消失了。通常,酶被荧光标记,它们的扩散系数用荧光相关光谱(FCS)测量。
图1:当(A)尿素和(B)过氧化氢转化为各自的产物时,脲酶(A)和过氧化氢酶(B)的扩散以依赖于底物浓度的方式增加。参考文献6和7。版权所有:美国化学学会
通过Langevin/Brownian动力学模拟,我们确定了每次周转12 pN和9 pN的力足以分别促进脲酶和过氧化氢酶的扩散6,11。这个计算是基于已知的周转率和每个反应是10 ns的脉冲时间,这个时间近似于离子从酶中扩散1个德拜长度然后消散所需要的时间。这些酶产生的力与运动蛋白产生的力相当,并且在激活整合素的范围内,整合素是负责细胞机械传感的生物吸附分子,通过催化产生的力可能是一种新的机械生物方法1,11-13。
催化诱导酶增强扩散的可能机制仍是一个未解决的问题,尽管下文所述提出来几个假设来解释实验观察结果,包括电泳、局部和全局热效应以及反应诱导的酶构象变化。
电泳现象
对于将中性尿素转化为离子 (铵离子和碳酸氢盐离子)的尿素酶来说,由于阳离子和阴离子的扩散系数不同,会形成局部电场。自生电场可驱动负电荷脲酶。然而过氧化氢歧化成水和氧的过氧化氢酶在催化过程中也表现出增强的扩散,这说明电泳力并不是酶增强扩散的普遍原因。Golestanian认为对于中性分子的反应,由于反应物和产物分子的不对称分布,酶的扩散也可能增加,导致酶附近产生化学梯度14。这导致酶的扩散振动,其方向取决于酶与反应物和产物分子相互作用的梯度和强度。然而,大多数酶的半径在几个纳米范围内,这意味着酶的旋转扩散时间在10-8秒的数量级。因此,快速旋转的活性位点不太可能在特定方向上产生底物/产物梯度。即使形成了浓度梯度,一个小的酶分子在布朗随机化使其旋转之前也不会察觉到梯度。
局部和全球的热效应
Bustamante 等人10观察到反应诱导可以增强放热酶的扩散,它的反应焓变从-45变到-100 kJ/mol (过氧化氢酶、脲酶和碱性磷酸酶),但热中性的磷酸丙糖异构酶不是这么多 (Delta;H = 3 kJ/mol) 15。基于以上观察,他们提出放热反应迅速释放热能,形成不对称压力波,导致酶活力增强 (化学感应效应)。然而,在这一理论中,他们忽略了对周围溶剂的快速传热,Golestanian16认为这种效应会导致溶剂温度升高,粘度降低,导致酶扩散率增加。然而, 实验测量发现缓冲溶液配制的1 mu;M脲酶和1 M尿素17反应时温度只增加了0.2 K,这表明观察到的热影响不会增强酶扩散系数。为了支持这一点,我们还观察到在果糖-二磷酸醛缩酶(是一个催化吸热的醇醛分裂反应)扩散中一个明显的反应-速率依赖的增加18 (Delta;H = 30-60 kJ/mol)。19-20
构象变化
催化过程中构象的变化引起的水动力是酶扩散增强的另一个潜在原因。Kapral、Mikhailov和其他人21minus;23提出了酶马达会导致运动是因为底物和产物在活性位点的催化循环引起的可逆变形,从而使流体流动。
在上面的情况中,我们假设催化对于酶扩散的增强是必不可少的。然而,Minteer和我们18,24已经观察到底物或竞争性抑制剂(在活性位点与底物结合竞争并诱导酶形态变化而不经过催化反应的物种)的可逆结合和非结合也会导致扩散增强。这表明构象变化是扩散增强的一个原因,实际的催化翻转可能是不必要的。在这些观察的基础上,最近提出了一种新的模型,用结合诱导构象变化来解释运动18。在底物存在的情况下,酶随机地在两个平衡态之间切换,自由态或结合到底物上。扩散系数的相对增强可以写成
式中(为无因次系数,取决于结合和不结合的酶的内部自由度,S为结合分子浓度,K为结合平衡常数。在该模型中,酶的扩散系数与底物浓度依赖方式的构象波动有关,与整体催化转化率无关。
酶趋化作用
假设一种酶通过底物结合和非结合可以产生足够的机械能来产生它自己的运动,那么问题就出现了,它是否能在底物浓度梯度也就是平行于细胞趋药性的方向定向运动,。Yu等人报道,在溶液中与RNA聚合酶和DNA模板在遇到其底物NTP25梯度时显示偏倚运动。我们采用双入口一出口微流体通道,荧光标记了的酶从一个入口进入,底物溶液从另一个入口进入。观察到酶明显向底物趋化转移7。为了进一步强调非平衡特性,我们设计了一个不同的微流控通道,它有三个入口和一个出口。己糖激酶 (利用ATP磷酸化的果糖)、果糖和Mg2 的混合物从三个通道一起流入,ATP被添加到中间通道的液体中。当ATP存在时,己糖激酶从侧通道进入中心通道,导致酶聚集(图2) 26。当果糖被非底物L -葡萄糖取代时,没有观察到这种现象。
图2. (A)微流控装置为三进一出通道。(B)己糖激酶、果糖和辅因子Mg2 通过所有三个通道。当ATP被添加到中间通道时,己糖激酶的分子会聚集在中间的通道。y轴表示通过通道的归一化荧光强度。(C)果糖被L -葡萄糖取代时未观察到聚集现象。参考文献26。版权由2018自然出版集团所有。
本文报道了酶的趋化行为的实际应用。一项特别的研究是使用趋化作用来分离一种活性酶和非活性酶的混合物27。实验采用双进五出口微流体通道。含有荧光标记的活性和非活性酶混合物的液体通过一个入口,含有酶底物的溶液通过另一个入口。活性酶迁移到含有底物的通道中,而非活性酶迁移到含有底物的通道中。一种基于纸张的酶的趋药性的分离装置也被报道,他们的更容易的分离。
此外,联酶反应的系列趋药性可能导致细胞中代谢分子的形成。参与反应级联的酶在第一个酶底物存在的情况下组装成代谢子。我们应用微流体和荧光光谱技术研究糖酵解级联前4种酶的协调运动:己糖激酶、磷酸葡萄糖异构酶、磷酸果糖激酶和醛缩酶。我们发现每一种酶都独立地遵循其特定的由前面的酶反应产生的底物梯度的规律。酶迁移的程度与酶接触底物梯度的时间成正比。值得注意的是,即使在模拟细胞质聚集的条件下,酶的趋化迁移也相当快。观察到的速率与报道的活细胞酶扩散速率非常相似。因此,趋化作用可能是细胞质中代谢网络组织的基础。
有趣的是,在研究参与序列反应的酶的趋化性时,我们还观察到酶群对底物的存在做出反应,这是分子水平上集体行为的一个例子26。我们发现,当己糖激酶和醛糖激酶暴露于己糖激酶的底物以及糖酵解序列反应中的其他两种酶时,两种酶的聚集随时间而形成,且己糖激酶和醛糖酶聚集的轨迹高度相关。
趋化作用的理论最早由Schurr 等人30提出,它解释了大分子探针在溶液中攀升结合配体浓度梯度的热力学趋势。后来,Guha等人用这个现象的一个稍微修改的版本来解释小染料分子向溶液中相互作用的高浓度聚合物的趋化性31。在实验验证之后的另一项理论工作中,Sitt等人预测,当表面上存在结合位点梯度时,探针分子会向结合位点密度较高的区域移动。本质上,结合被认为是这些系统中分子趋化的热力学起源。
通过对Schurr的理论的修正,我们提出了一种基于底物可逆结合的活性酶趋化行为模型26。根据这个模型,趋化漂移是由于有利配体的结合而降低系统化学势的热力学驱动力引起的。底物梯度诱导的酶交叉扩散趋化作用与酶的Fickian扩散方向相反,酶会转移到底物浓度较高的区域。酶e在底物s存在下的浓度Ce的扩散流可以写成
其中D为酶的布朗扩散系数,DXD为交叉扩散系数,Ce和Cs分别为酶浓度和底物浓度的梯度。交叉扩散系数DXD是局部底物浓度Cs、扩散系数D和底物与酶结合的平衡常数K的函数
把这两个方程结合起来就得到了
这个方程突出了驱动交叉扩散通量的因素。括号内的第一项是传统的向低浓度酶扩散通量。第二项是酶的趋化通量,它的正号表示这种通量是向着底物浓度更高的方向。除了底物梯度之外,这一项的大小由扩散系数D、酶浓度Ce和与在给定时间内底物所占结合位点比例成比例的因子决定
与之前的发现相反,Jee等人最近报道了尿素酶和乙酰胆碱酯酶从各自的底物中分离出来,这被称为抗趋化34。在理论方面,对酶的抗趋化的可能性已经做出假设35,36。Agudo等人认为,酶的趋化性是两种相互竞争现象的共同结果,一种是由非特异性相互作用引起的原子间的致电性运动导致的趋化性,另一种是酶底物结合导致的扩散增强导致的负趋化性。然而,在实验中已经观察到,当没有结合时,就没有趋化性,尽管可能仍然存在非特异性的相互作用(例如,己糖激酶对D-葡萄糖的趋化性,但对L-葡萄糖不产生趋化性)26
相比之下,我们提出的包含结合诱导交叉扩散的模型是通用的,没有可变的参数26,38。此外,酶扩散的变化影响交叉扩散通量的是大小而不是方向,预测趋化作用的发生对任何两个分子物种之间有利的结合作用38。
能量传递到周围
有几篇报道说,真正的和合成的微米大小的活性粒子(如细菌39,40,藻类41,42,和双金属棒43,44)都将它们的动量转移到周围,导致悬浮示踪剂的扩散增强。有趣的是,这些发动机似乎都以类似的方式向周围传递能量,示踪扩散随着活性粒子的数量、密度和速度的增加而增加,尽管它们的推进机制有所不同。我们想通过在超低雷诺数的条件下观察分子尺度的现象来进一步探究这个问题。研究中使用了脲酶和醛糖酶,结果表明,在它们存在的情况下,从纳米到微米的无源示踪剂以一种依赖于活性增强了扩散45。此外,当催化反应速率保持不变时,示踪扩散增强与示踪颗粒的大小呈反比关系。根据我们的观察,我们假设酶在细胞质的动态环境中起着至关重要的作用,因为在催化过程中,
全文共20930字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[31],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 复杂热电材料外文翻译资料
- 以自蔓延高温烧结方法制备热电化合物以及燃烧合成的新标准外文翻译资料
- 氮掺杂分级多孔碳作为氧还原反应的高效电化学催化剂的研究外文翻译资料
- 孪晶诱导塑性高嫡合金的设计外文翻译资料
- 含铌先进Fe-Cr-Ni型奥氏体耐热钢富铜相的析出强化在超临界电厂的应用外文翻译资料
- 不同温度下直接能量沉积层状工具钢的弯曲强度外文翻译资料
- BiFeO3的光伏效应外文翻译资料
- 通过氢稳定的MgaPt研究核壳纳米结构Mg@Pt中快速“氢泵”的可视化外文翻译资料
- 一种铱核心环金属有机配体显著地提高了有机太阳能电池 的光伏性能外文翻译资料
- 钠离子电池的高性能阳极材料:三组分共组装法制备层次多孔碳外文翻译资料


