
英语原文共 11 页,剩余内容已隐藏,支付完成后下载完整资料
不含多不饱和脂肪酸的高油酸酵母油
摘要
背景:富含油酸的甘油三酸酯非常适合需要高氧化稳定性的润滑剂应用。脂肪酸碳链长度和去饱和度是决定甘油三酸酯性能的关键因素,在生物体中控制脂肪酸组成的能力对于得到满足特定应用需求的生物基油的来源至关重要。
结果:我们试图工程改造产油酵母解脂耶氏酵母,以生产高油酸甘油三酯油。我们研究了脂肪酸和甘油三酯合成途径中缺失和过表达的影响,以鉴定提高油酸水平上的修饰。通过将天然∆9脂肪酸去饱和酶和3-磷酸甘油酰基转移酶与异源酶交换,以及Delta;12脂肪酸去饱和酶的缺失和脂肪酸延伸酶的表达,促进了甘油三酯中油酸的积累。通过结合这些工程步骤,我们消除了多不饱和脂肪酸,并创建了解脂耶氏酵母菌株,该菌株积聚了油酸含量大于90%的甘油三酸酯。
结论:高油酸酯含量和缺乏多不饱和酸酯使这种三酰基甘油酯油与植物油和藻类衍生油区别开来。其成分使该油适合于需要高氧化稳定性的应用,并进一步证明了解脂耶氏酵母作为特定脂质谱的生产者的潜力。
关键词:油酸、单不饱和、甘油三酸酯(TAG)、酵母、润滑剂、氧化稳定性
背景:
石油是世界经济增长的重要推动者,其应用范围从燃料,润滑剂,塑料和化学药品到食品,药品和个人护理产品。应用的多样性源于不同组成的油所展现的广泛性能。工业上使用的大多数石油来自石油及其精炼成分,其中生物基油占一小部分。尽管由生物体得到的脂质具有很大的多样性,已经从少数的农作物和家畜中产生了大量的脂质,但其成分和应用受到限制。生物技术能够控制诸如某些酵母和藻类等油质可培养生物的脂质组成,从而为生产具有潜在改良或新特性的特定油创造了一个灵活的平台。因此,可以在各种原料上大规模生产石油化学替代品,以满足特定的石油应用。安全,遗传易加工且工业上可靠的解脂耶氏酵母正在成为代谢工程学生产乙酰辅酶A衍生分子(例如常见和不寻常的脂肪酸,脂肪醇,脂肪酯,beta;类胡萝卜素,烷烃和萜烯)的首选平台。
在过量碳的存在下,营养物质的限制导致脂质积累,并涉及通过I型脂肪酸合酶(FAS)合成脂肪酰基辅酶A,通过延长酶和去饱和酶修饰链长和去饱和度,以及掺入甘油三酸酯(TAG),通过一系列酶促步骤:3-磷酸甘油酰基转移酶(GPAT)将第一个脂肪酸附着在甘油主链上,产生溶血磷脂酸(LPA);溶血磷脂酸酰基转移酶(LPAT)连接第二种脂肪酸,生成磷脂酸(PA);PA被磷酸酯磷酸酶(PAP)去磷酸化,生成二酰基甘油(DAG)。二酰基甘油酰基转移酶(DGAT)活性会添加最终脂肪酸以产生TAG。解脂耶氏酵母基因组编码两个延伸酶(YALI0F06754,YALI0B20196),一个Delta;9去饱和酶(OLE1YALI0C05951),一个Delta;12去饱和酶(FAD2YALI0B10153),两个GPAT(SCT1YALI0C00209,GPAYALI0A1E1964),一个LPAT(SLC1YALI0E18964),一个PAP(PAH1YALI0D27016)和两个DGAT(DGA1YALI0E32769,DGA2YALI0D07986)[17-19]。酿酒酵母[20,21]与解脂耶氏酵母之间的途径保守性表明,TAG生物合成途径与磷脂合成之间存在显着的串扰。
在这项研究中,我们探索了解脂耶氏酵母生产高油酸TAG油的潜力。 高油酸TAG油在食品工业中具有应用,作为油酸衍生产品的化学中间体和润滑剂。用于润滑油的两个关键品质是高氧化稳定性和在很宽的工作温度范围内保持液态的能力[22]。氧化稳定性与脂肪酸碳链中双键的数量有关。多不饱和脂肪酸特别容易受到氧化作用的侵害,氧化是润滑剂降解的主要机理。饱和脂肪酸具有氧化稳定性,但温度范围有限。单不饱和脂肪酸是一个很好的折衷方案,具有良好的氧化稳定性和较宽的适用温度范围[23]。解脂耶氏酵母TAG油的天然成分主要由具有最多两个去饱和键(C16:0,C16:1Delta;9,C18:0,C18:1Delta;9和C18:2Delta;9Delta;12)的长链脂肪酸组成[24]。我们使用基因缺失和异源基因的表达来定制脂质合成和TAG积累,以生产具有比石油基油更好或更好的性能的生物润滑油。我们报告了解脂耶氏酵母菌株的工程设计,该菌株产生的油高度富含单不饱和脂肪酸,且不含多不饱和脂肪酸,其油酸酯含量超过总脂肪酸的90%。
结果和讨论:
我们先前基于最小的柠檬酸分泌,非菌丝形态和易于遗传操作将野生型解脂耶氏酵母菌株YB-392鉴定为合适的起始菌株[24]。在此背景下,我们研究了一组遗传修饰对脂肪酸合成和TAG存储的影响,然后将有利于油酸积累的修饰组合到单个菌株中。
消除多不饱和脂肪酸
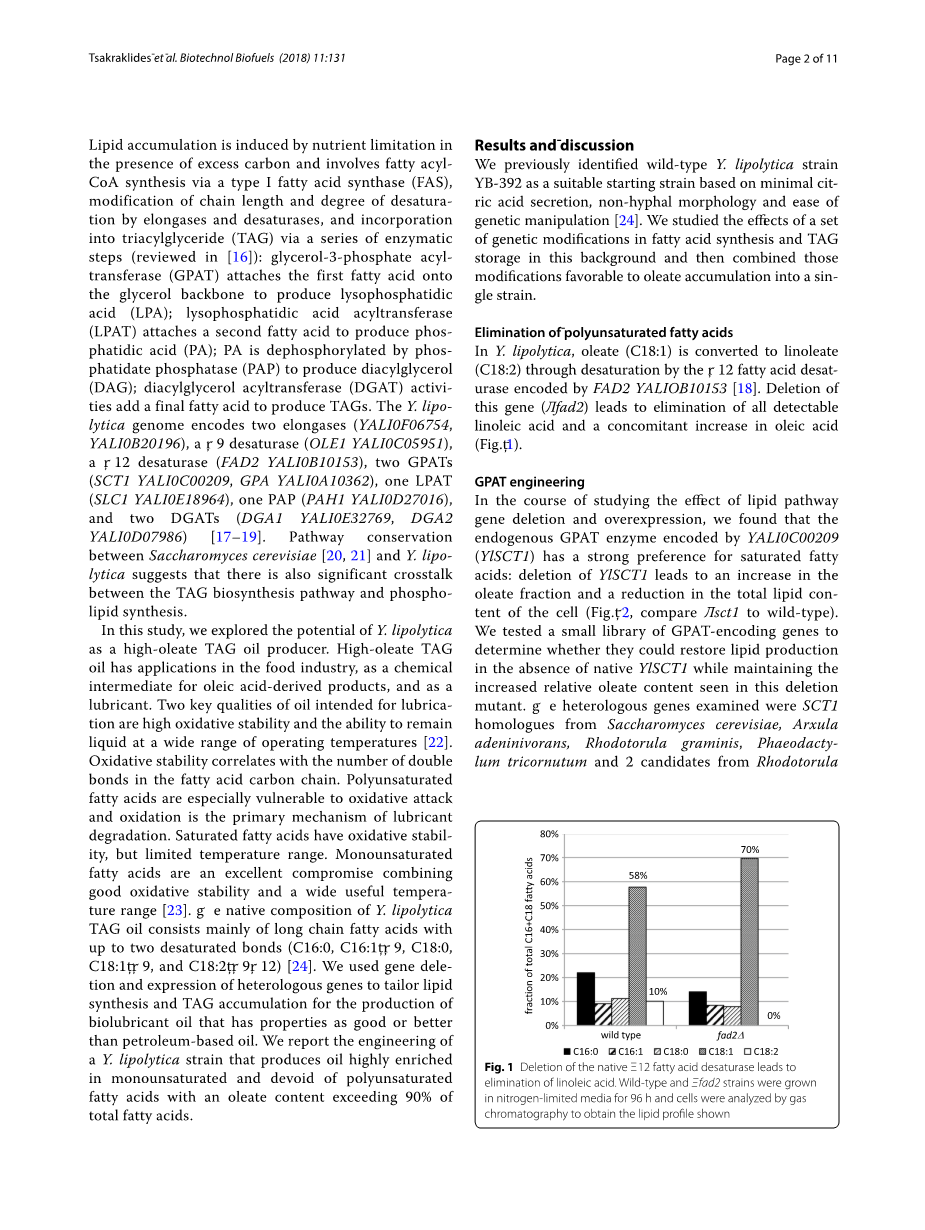
在解脂耶氏酵母中,油酸(C18:1)通过由FAD2YALIOB10153编码的Delta;12脂肪酸去饱和酶去饱和而转化为亚油酸(C18:2)[18]。删除该基因(Delta;fad2)可消除所有可检测到的亚油酸,并随之增加油酸(图1)。
图1.天然的∆12脂肪酸去饱和酶的缺失导致亚油酸的消除。野生型和Delta;fad2菌株在限氮培养基中生长96h,并通过气相色谱分析细胞,获得脂质分布
GPAT工程
在研究脂质途径基因缺失和过表达的影响过程中,我们发现YALI0C00209(YlSCT1)编码的内源3-磷酸甘油酰基转移酶(GPAT)酶对饱和脂肪酸具有强烈的偏好:YlSCT1的缺失导致油酸分数增加,并且降低细胞中总脂质含量(图2,将Delta;sct1与野生型进行比较)。我们测试了一个小的GPAT编码基因文库,以确定它们是否可以在不存在天然Y1SCT1的情况下恢复脂质的产生,同时保持该缺失突变体中相对油酸含量的增加。检查的异源基因是来自酿酒酵母的SCT1同源物,Arxulaadeninivorans,Rhodotorulagraminis,Phaeodactylumcorncornutum和2个来自Rhodotorulateuloides的候选物,以及来自Naumovozymadairenensis和Naumovozymacastellii的GPAT基因GPT2(序列在附加文件1中)。这些候选物与YlSct1蛋白具有39-52%的一级序列同一性。在强组成型YlTEF1启动子的控制下,将含有YlSCT1或这8个异源GPAT基因之一的表达盒与zeocin抗性标记偶联,将其转化为Delta;sct1Delta;fad2双重缺失菌株(图2)。我们没有进一步研究未改善脂质含量的GPAT基因。未能提高脂质含量可能与解脂耶氏酵母中弱表达或酶活性低有关(例如折叠错误,翻译后修饰缺失,定位错误以及天然脂肪酸活性低)。我们发现,几个GPAT都可以将脂质含量提高到野生型水平,并保持亲本菌株的高油酸组成。
这些发现强调了工程酰基转移酶特异性对通过将所需脂肪酸稳定化成储藏脂质来调节脂质含量的重要性。选择AdeninivoransSCT1(AaSCT1)进行后续菌株工程设计,是因为它对脂质含量,维持高油酸水平以及该酵母与解脂耶氏酵母的紧密同源性具有积极作用[25]。
图2.解脂耶氏酵母中的异源GPAT表达。将8个异源GPAT基因和天然GPATYlSCT1分别转化为Delta;sct1Delta;fad2双缺失菌株。通过荧光测定法和气相色谱法分析细胞,并显示了转化体的平均值。误差棒代表标准偏差值。总脂质含量报告为荧光的任意单位除以标准化为野生型菌株的600nm处的光密度(FL/OD)。油酸水平以定量的总C16和C18脂肪酸的百分数表示每个基因的16个转化体以及对照菌株的副本在限氮培养基中生长72小时。
Delta;9去饱和酶工程
解脂耶氏酵母表达单个Delta;9脂肪酸去饱和酶,并产生两个Delta;9去饱和的脂肪酸:棕榈油酸(C16:1 Delta;9)和油酸(C18:1 Delta;9)。我们试图改变我们菌株的不饱和脂质谱,以减少棕榈油酸,而有利于油酸。为此,我们删除了天然Delta;9脂肪酸去饱和酶基因(ole1::hph),导致单不饱和脂肪酸营养缺陷。我们证实了用YlOLE1转化该菌株可以在不补充培养基的情况下恢复生长,并且我们使用此选择研究了一组旨在替代抗生素的异源Delta;9脂肪酸去饱和酶基因(附加文件1中提供的序列)的脂质谱表型,这些基因旨在取代ole1::hph处的抗生素抗性标记。用两个Rhodotorula graminis和Rhodotorula toruloides的OLE1同源物进行转化,在未添加培养基的情况下没有可存活的菌落,这表明这些基因未成功表达能够补充内源性脱氢酶缺失的Delta;9脂肪酸脱氢酶。就像没有产生所需表型的GPAT基因一样,这些OLE1同源物也没有进一步研究。油酸原营养互补的缺乏可能是由于表达差或酶活性差所致。相反,来自Arxulaadeninivorans,Microbotryumviolaceum,Pucciniagraminis,Gloueophyllumtrabeum的基因和来自Rhodotorulatoruloides的第二个同源物都与Delta;ole1互补,可在不补充培养基的条件下生长。选择每种转化的两个分离株用于进一步分析。对基因组基因座的PCR分析以及在含有潮霉素的培养基上的平板接种证实了异源OLE1基因的插入,代替了潮霉素抗性基因(数据未显示)。我们将十个异源OLE1菌株的脂质谱与野生型进行了比较(图3)。这项研究中包含的异源脱氢酶硬脂酸(C18:0)比棕榈酸(C16:0)更倾向于作为去饱和反应的底物。A.deninivorans和P.graminisOLE1比天然基因产生更高的相对油酸含量。
图3.解脂耶氏酵母中的异源Delta;9脂肪酸去饱和酶表达。在分别转化进Delta;ole1菌株的7个异源Delta;9脂肪酸去饱和酶基因中,有5个产生了无需单不饱和脂肪酸补充即可生长的转化子。每个基因的两个分离物以及野生型菌株的复制品在限氮培养基中生长96小时,并通过气相色谱法分析细胞以获得所示的脂质谱
高油酸菌株工程与表征
我们结合以上发现,设计出了一个高油酸菌株(图4)。首先,使用zeocin抗性盒在Delta;sct1背景中表达AaSCT1(解脂耶氏酵母TEF1启动子),导致油酸水平升高。我们观察到,删除了sct1的菌株积累了油酸降解产物7-十六碳烯酸酯C16:1Delta;7,并且从此刻起,我们将该物种包括在我们的脂质组成分析中。这种脂肪酸是油酸单次beta;-氧化的结果,以前在菌株中观察到了3-磷酸甘油酯穿梭被gut2缺失破坏的菌株[26,27]。我们假设在sct1缺失的细胞中剩余的GPAT活性对该降解产物具有底物偏爱,并导致其在TAG中的富集。随着AaSCT1的表达,C16:1Delta;7水平从总脂肪酸的6%降低到1%(图4b,将Delta;sct1AaSCT1与Delta;sct1进行比较)。
为了将单不饱和含量从C16转移到C18,我们像以前一样将天然的Delta;9去饱和酶替换为P.graminisOLE1(图3)。所得的Delta;sct1 AaSCT1 ole1::PgOLE1菌株表现出先前观察到的C18:0底物偏好。棕榈油酸从天然YlOLE1亲本菌株中的21%降至2%,而C18Delta;9产物(油酸和亚油酸)从67%增至78%(图4b)。
为了消除多不饱和脂肪酸,接下来将Delta;12去饱和酶删除。由于亲本菌株的高亚油酸含量,这种修饰的效果尤为明显(图4b)。删除去饱和酶后未观察到亚油酸,并且油酸酯含量从62%增加至82%。
所得菌株Delta;sct1AaSCT1ole1::PgOLE1Delta;fad2仍含有10%棕榈酸(C16:0)。我们试图通过大鼠延长酶rELO2的表达将这种脂肪酸转移到C18库中,该酶先前已被证明可以增加酿酒酵母中的油酸酯含量[28]。用蔗糖利用盒表达rELO2(解脂耶氏酵母EXP1启动子)。同时,共转化了用于表达 Rhodotorula teuloides DGA1(解脂耶氏酵母GPD1启动子)的未标记盒,以增加菌株的总脂质含量[24]。在含有蔗糖作为唯一碳源的平板上选择转化子,然后筛选脂质产生,以鉴定具有高油酸酯组成的高脂质含量分离物。在rELO2-RtDGA1转化子中选择了具有最高脂质水平的最高油酸酯生产者。
作为增加油酸含量的最后一步,使用亚磷酸酯利用盒[29]来表达另一份P.graminisOLE1拷贝(A.adeninivoransTEF1启动子)。将未标记的表达RtDGA1(解脂耶氏酵母GPD1启动子)和ClavicepspurpureaDGA2(解脂耶氏酵母TEF1启动子)的表达盒与Puccinia graminisOLE1共转化,以进一步增加总脂质含量[24]。在亚磷酸酯板上选择转化子,然后筛选脂质的产生。NS993菌株以最高的油酸和脂质产生物(图4b,c)出现,在96孔板生长条件下达到86%的油酸盐和89%的单不饱和脂肪酸,没有多不饱和脂肪酸。
图4.高油酸菌株工程。解脂耶氏酵母中脂肪酸和TAG合成的简化途径用于说明高油酸菌株NS993中的基因缺失(Ylole1,Ylsct1,Ylfad2)和异源基因表达(PgOLE1,AaSCT1,rELO2,RtDGA1,CpDGA2)(a)将指定的菌株在限氮培养基中一式三份生长96小时。通过气相色谱和荧光分析法分析细胞以获得脂质谱。(b)和脂质含量(c)显示。脂肪酸水平报告为定量的总C16和C18脂肪酸的百分数。总脂质含量报道为归一化为野生型的FL/OD。显示的值是一式三份培养物的平均值,误差线代表标准偏差。FAS脂肪酸合酶,GPAT:3-磷酸甘油酰基转移酶,LPAT溶血磷脂酸酰基转移酶,PAP磷脂酸磷酸酶,DGAT二酰基甘油酰基转移酶,TAG三酰基甘油
随机整合转化产生一系列表型表达,这可能是由于整合基因组位点的表达水平不同,整合事件的数量或内源基因的偶然破坏所致。我们使用PacBio测序(SyntheticGenomics,LaJollaCA)对NS993基因组进行了
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[245498],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 通过高效供应一碳单位提高工程大肠杆菌中L-蛋氨酸的产量外文翻译资料
- 基于功能组学分析嗜热真菌嗜热毛壳菌纤维素降解机制外文翻译资料
- 采用原位分离丁醇的方式提高菠萝叶木质素水解物发酵产丁醇的量外文翻译资料
- 含锆金属有机框架和微波加热,将葡萄糖转化为5-羟甲基糠醛外文翻译资料
- 零价纳米铁颗粒和根际微生物对白柳植物修复能力的影响极其响应外文翻译资料
- 超声辅助深共晶溶剂萃取法绿色高效提取黄酮类化合物外文翻译资料
- 工业发酵过程中微生物竞争优势的代谢工程外文翻译资料
- w-转氨酶级联反应的最新进展外文翻译资料
- Bi2WO6微/纳米结构:合成、改性及可见光驱动光催化应用外文翻译资料
- 磷酸氧阴离子修饰的Bi2WO6/聚酰亚胺复合材料对四环素的太阳光催化降解外文翻译资料


