
英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
基于MOF的纳米管通过蛋白质诱导的软模板途径形成中空纳米球
摘要:
通过蛋白质诱导的软模板途径,建立了一种可控的、简便的策略来构建基于金属有机框架(MOF-based)中空复合材料。使用金属-脱氧胆酸钠水凝胶作为软模板,在蛋白质缺失的情况下获得纳米管。在蛋白质存在的情况下,通过改变蛋白质的含量来制备空心纳米球结构。为了验证所提出途径的广泛性,两种蛋白(伯克霍尔德菌脂肪酶和青霉素G酰基转移酶)和三种金属有机框架(ZIF-8、ZIF-67和Fe-MOF)被采用作为模型蛋白和材料,得到的含蛋白复合物(命名为protein@H-MOF)具有较高的生物活性和稳定性。在温和条件下,该策略为制备基于金属有机框架的复合材料提供了一种简便的方法,促进了金属有机框架在生物催化剂构建、生物分子包封和药物传递等领域的应用。
正文:
由于其独特的拓扑结构和性能,金属有机框架(MOFs)在气体吸附、药物传递、催化和固定化酶等领域引起了广泛的关注。在过去的几年里,通过使用不同的金属有机框架为载体,用不同的方法成功地制备了各种类型的纳米生物催化剂。近年来,胶囊材料和空心球材料都因为能够为生物分子提供良好的微环境而受到越来越多的关注。中空腔可容纳高装载量的生物分子货物,并且薄的胶囊壁使所得纳米复合材料具有快速传质,低的货物浸出率,高的活性回收率。脱氧胆酸钠(NaDC)是一种水溶性胆盐,它作为一种生物相容的表面活性剂用于纯化DNA和蛋白质,在生物学和医学中具有重要意义。脱氧胆酸钠水凝胶能保持较高的生物分子活性。因为大小和形状可调,金属- 脱氧胆酸钠水凝胶是制备中空材料的理想模板。金属- 脱氧胆酸钠水凝胶的形成受到离子浓度、pH等多种条件的影响。此外,金属-脱氧胆酸钠水凝胶的高生物相容性还可以保护生物分子免受极端非生理环境的影响。
因此,在本文中,金属- 脱氧胆酸钠水凝胶被采用作为软模板,用一种简单的方法构建基于金属有机框架中空复合材料。作为金属有机框架的一个亚科,沸石咪唑酯框架材料(ZIFs)是由过渡金属离子与咪唑衍生物配体配位形成的具有沸石框架结构的多孔晶体材料。因为ZIF-8具有高的比表面积和显著的化学稳定性和热稳定性,因此选择ZIF-8作为基于金属有机框架中空复合材料的模型材料。伯克霍尔德菌脂肪酶(BCL, EC 3.1.1.3)是一种广泛用于水解、酯化和酯基转移作用的水解酶,所以选择它作为本次研究的模型蛋白。
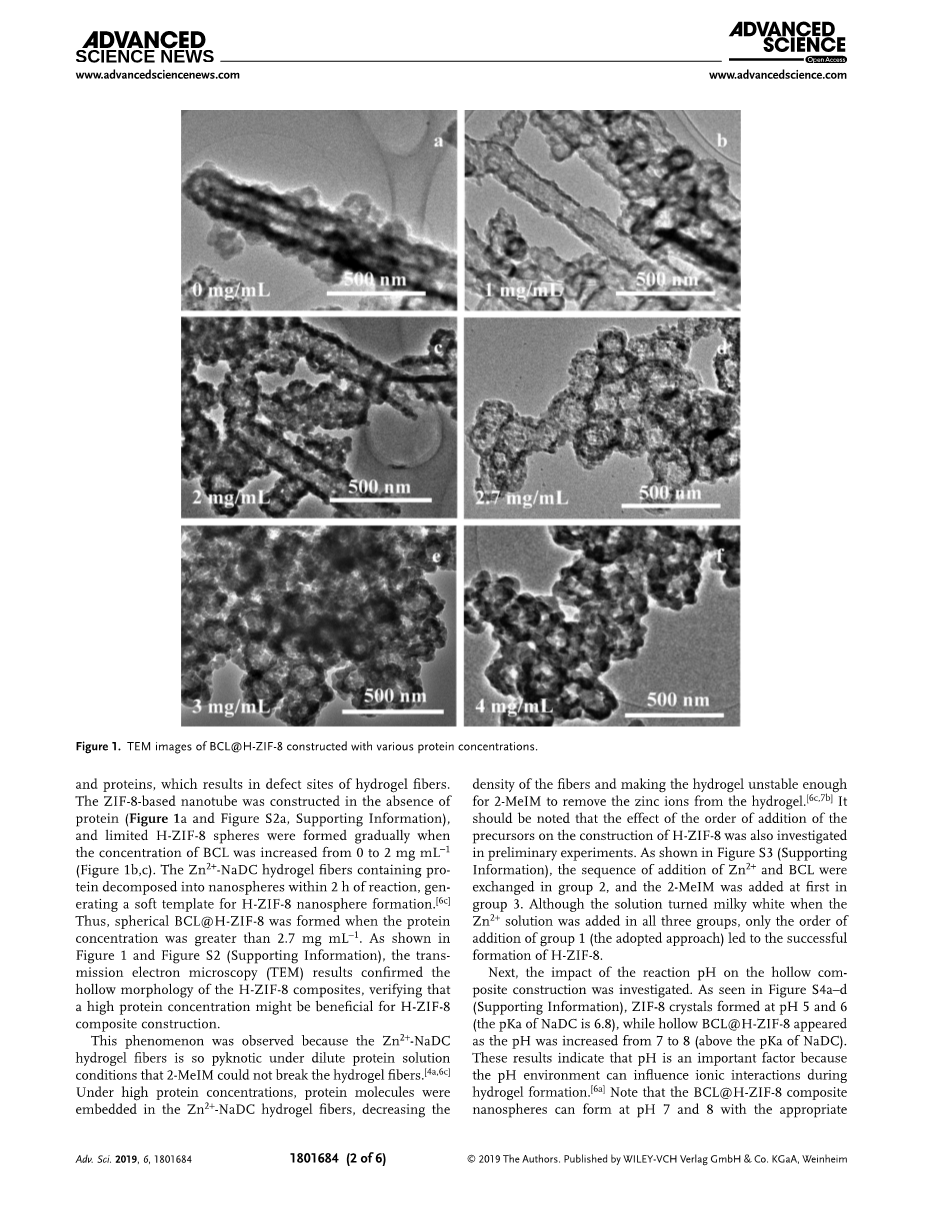
首先研究了反应条件对Zn2 -NaDC水凝胶纤维形态的影响以及随后基于ZIF -8中空复合材料(H-ZIF-8)的构建。在没有BCL(图S1a,支持信息)的情况下,在pH值为7时,Zn2 和NaDC自聚集作用形成光滑的Zn2 -NaDC水凝胶纤维。图S1b-f(支持信息)显示了不同BCL浓度下Zn2 -NaDC水凝胶纤维的表面形态,可以看出随着BCL蛋白浓度的增加,Zn2 -NaDC水凝胶纤维的表面变得越来越粗糙。在水凝胶形成后,加入2-甲基咪唑(2-MeIM)作为ZIF-8的配体。流变学性质的结果(图S1g,h,支持信息)表明,随着蛋白量的增加,水凝胶表现出越来越多的类固体流变行为,这与扫描电镜(SEM)图像一致。这种现象可以归因于蛋白质的多重羧酸基团结构影响了NaDC与金属离子之间的相互作用。此外,金属离子与蛋白质分子羧酸基团的相互作用可能导致金属离子和蛋白质的聚集,从而导致水凝胶纤维的缺陷部位。在没有蛋白的情况下,构建了基于ZIF -8的纳米管(图1a和图S2a,支持信息),当BCL浓度从0增加到2 mg mLminus;1时,逐渐形成有限的H-ZIF-8球(图1b,c)。在含有蛋白质的Zn2 -NaDC水凝胶纤维中反应2小时内分解成纳米球,生成H-ZIF-8纳米球形成的软模板。因此,当蛋白质浓度大于2.7 mg mLminus;1时,形成球形BCL@H-ZIF-8。如图1和图S2(支持信息)所示,通过电镜(TEM)的结果证实了H-ZIF-8复合材料的中空形态,验证了高蛋白浓度可能有利于H-ZIF-8复合材料的构建。
图1 不同蛋白浓度条件下含酶中空MOF粒子的TEM图片
这种现象是由于Zn2 -NaDC水凝胶纤维在稀释的蛋白溶液条件下很致密以致于2-甲基咪唑不能破坏水凝胶纤维所引起的。在高蛋白质浓度下,蛋白质分子被嵌入到Zn2 -NaDC水凝胶纤维中,降低了纤维的密度并且使水凝胶足够不稳定,从而使2-甲基咪唑能够从水凝胶中除去锌离子。值得注意的是,前体加入顺序对H-ZIF-8结构的影响也在初步的实验中进行了研究。如图S3(支持信息)所示,在第2组中,Zn2 和BCL的添加顺序发生了交换,在第3组中首先添加2- 甲基咪唑。虽然三组均加入Zn2 溶液后溶液呈乳白色,但只有加入第1组的顺序(采用的方法)才能成功形成H-ZIF-8。
其次,对反应的pH对中空复合材料结构的影响做了实验。如图S4a-d(支持信息)所示,ZIF-8晶体在pH值为5和6(NaDC的pKa值为6.8)时形成,而当pH值从7增加到8(高于NaDC的pKa值)时出现中空BCL@H-ZIF-8。这些结果表明pH是一个重要的因素,因为pH环境会影响水凝胶形成过程中的离子相互作用。值得注意的是,在pH值为7和8的条件下,适当的蛋白浓度可以形成BCL@H-ZIF-8复合纳米球(图1,图S1和S5a,支持信息)。
图2 在不同Zn2 浓度下构建BCL@H-ZIF-8的TEM图像
Zn2 浓度的影响是离子相互作用的另一个重要因素,在0.075 ~ 0.6 times; 10minus;3 mol/L范围内也进行了研究(图2)。从图2a,b可以看出,在Zn2 浓度低于0.15 times; 10minus;3 mol/L时,BCL@H-ZIF-8复合球没有形成,这可能是因为过低的金属离子浓度对Zn2 -NaDC水凝胶和ZIF-8的形成都有不利影响。SEM和TEM结果(图1c、图S2c, 支持信息和图2、图S6, 支持信息)表明,0.3 times; 10minus;3 mol/L 是Zn2 形成具有理想形态的H-ZIF-8的合适浓度。
BCL@H-ZIF-8的x射线衍射(XRD)图谱中包含了ZIF-8的主要晶体结构面,顶峰位于7.5°、10.5°和12.5°(图S5b,支持信息),表明在BCL@H-ZIF-8上ZIF-8晶体的形成是成功的,这与之前的报道一致。在不同的Zn2 浓度和pH值下构建的复合材料的XRD谱图如图sfc,d(支持信息)所示。值得注意的是,各种BCL@H-ZIF-8的XRD谱图中出现了一些不同的峰。从这些结果可以看出,蛋白质浓度、pH值和Zn2 浓度不仅影响复合材料的形态,而且改变了复合材料的晶体形态。因此,通过考虑XRD数据、SEM和TEM结果可以得出,只有在适当的条件下,才能制备出定义良好的中空BCL@H-ZIF-8纳米球。
在上述结果的基础上,提出了基于金属有机框架复合材料的形成机理,并在方案1中进行了描述。羟基和羧基使NaDC分子具有平面极性并且能提供足够的负电荷,这是金属离子-NaDC在水溶液中聚集所必需的。如方案1a所示,当蛋白质缺失时,在水凝胶纤维模板周围形成的是基于金属有机框架纳米管,而不是中空球。如图1b所示,蛋白质分子首先聚集到软金属离子表面活性剂纳米纤维水凝胶中。Zn2 离子不仅可以与NaDC分子聚集,也可以与蛋白质分子聚集,因为蛋白质分子也有与NaDC分子一样的羧基。这可能会随着蛋白质浓度的增加而逐渐增加缺陷位点的形成,从而影响水凝胶纤维的紧密度和粗糙度(图S1,支持信息)。结果表明,2-甲基咪唑更容易从水凝胶中捕获Zn2 离子。换句话说,因为Zn2 -NaDC水凝胶纤维中存在蛋白质分子,所以溶液中的Zn2 离子和Zn2 -NaDC水凝胶纤维可以同时被2-甲基咪唑捕获。当缺陷位点的Zn2 离子被2-甲基咪唑捕获后,水凝胶纤维可能会逐渐分解成纳米球。并且水凝胶纳米球可以作为合成H-ZIF-8复合材料的软模板。此外,随着Zn2 -NaDC水凝胶纤维被2-甲基咪唑带走,在洗涤过程中,Zn2 -NaDC水凝胶纤维容易被分解和去除。此外,碱性2-甲基咪唑溶液会改变反应体系的pH值,从而影响水凝胶纤维的形态并且进一步影响在适当蛋白质浓度下H-ZIF-8复合材料的形成。因此,我们建立了一种新的蛋白质诱导的方法来可控地构建基于金属有机框架中空复合材料。
方案1 软模板法制备MOFs纳米管(a), 蛋白诱导法制备含蛋白中空MOFs粒子(b)示意图
图3 含酶中空MOF粒子的STEM图片 (a, c); 元素分布图像 (b) 和 元素线扫图片 (d)
此外,x射线光电子能谱(XPS)的结果(图S7a,支持信息)表明锌离子和氮之间存在一个键。傅里叶变换红外光谱(FTIR) 在421 cmminus;1波段(图S7b,支持信息)可以表现为Zn-N键拉伸,这也证实了ZIF-8框架结构的成功形成。BCL@H-ZIF-8的孔径分布证实了BCL@H-ZIF-8中存在微孔(1.580 nm)和介孔(3.403 nm),进一步验证了ZIF-8的微孔结构保持不变,介孔出现在中空纳米球的壳内。一般来说,介孔的存在可以提供更大的孔体积,并可能降低微孔材料的Brunauer - Emmet - Teller (BET)表面积。与纯的ZIF-8 (1012 m2 gminus;1,图S7d,支持信息)相比,BCL@H-ZIF-8 (38.3 m2 gminus;1,图S7c,支撑信息)的BET比表面积降低,这可能是由于壳层中存在介孔(3.403 nm)。TEM图(图3a,b)和TEM线扫描图(图3c,d)显示Zn元素均匀分布在壳体上并且证实了BCL@H-ZIF-8的中空结构。考虑到生物分子总是需要中性的pH条件,在后续的实验中,BCL@H-ZIF-8的构建条件为:2.7 mg mLminus;1蛋白质,0.3 times; 10minus;3 mol/L的 Zn2 , pH为 7。
为了研究BCL@H-ZIF-8的性能并且验证金属- NADC水凝胶对BCL分子的保护作用,所以对BCL@H-ZIF-8的活性和稳定性进行了研究。在构建复合材料的过程中,在上清液中没有检测到的蛋白质,所以蛋白质几乎被包裹在复合材料中。从表S1和S2(支持信息)中可以看出,获得的BCL@H-ZIF-8比BCL嵌入纯的ZIF-8晶体形成的复合物(BCL@ZIF-8, 8.749%)具有更高的活性回收率(69.58%)。高的活性回收率可能是由于以下原因: (1) Zn2 -NaDC水凝胶在H-ZIF-8构建过程中为BCL提供了适宜的微环境; (2) H-ZIF-8多孔薄壁可降低传质阻力并且保护BCL分子免受外界生物毒性分子的侵害; (3)腔内BCL分子的自由态有利于BCL与底物分子的相互作用。
表1 游离BCL的动力学参数,BCL@ZIF-8和BCL@H-ZIF-8。
一般来说,固定化的动力学参数的变化总是与游离酶的动力学参数的变化相比有一个数量级差距。从表1可以看出,与游离BCL相比,BCL@ZIF-8的Km (Michaelis-Menten常数)急剧增加,并且Kcat(转换数)和Kcat/Km均下降。此外,BCL@H-ZIF-8的Kcat值稍微下降,表明BCL与底物分子之间的亲和力降低。表观Km的增加和Kcat/Km的减少可能是由于底物或产物进入和离开中空纳米球的质量传输阻力。此外,Km和Kcat的微小变化也表明,在BCL@H-ZIF-8的构建过程中,BCL分子的构象和结构受到了保护。因此,动力学参数和活性回收率结果表明,与制备ZIF-8固定化酶的仿生矿化工艺(BCL@ZIF-8)相比,本文提出的制备BCL@H-ZIF-8的方法可以更好地保护复合材料中的蛋白质。
此外,从表S1和图S8(支持信息)中可以看出,BCL@H-ZIF-8 (0.01029 sminus;1)的观测速率常数(Kobs)值略小于游离BCL (0.01513 sminus;1)的值。Kobs结果表明,具有生物相容性的Zn2 -NaDC水凝胶能最大限度地减少蛋白质构象变化,同时保持较高的活性。此外,如图S9(支持信息)所示,游离BCL和BCL@H-ZIF-8分别与木瓜蛋白酶、胰蛋白酶和碱性蛋白酶温育反应3 h。BCL@H-ZIF-8比游离BCL保留更多的活性,这说明H-ZIF-8外壳可以通过阻止蛋白酶进入球来保护BCL不被水解。
极性有机溶剂,如乙腈,因为是蛋白质的变性剂,所以它通常会使酶活性急剧下降,但乙腈不可避免地经常被用作酶工业催化的溶剂。如图4a所示,为了验证在乙腈中的酶耐受性,将游离BCL和BCL@H-ZIF-8在40% (v/v)的乙腈溶液中反应一定时间。游离BCL和BCL@H-ZIF-8的活性在反应初期10min内分别保持70.23%和98.62%。反应130 min后,BCL@H
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[257326],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 通过高效供应一碳单位提高工程大肠杆菌中L-蛋氨酸的产量外文翻译资料
- 基于功能组学分析嗜热真菌嗜热毛壳菌纤维素降解机制外文翻译资料
- 采用原位分离丁醇的方式提高菠萝叶木质素水解物发酵产丁醇的量外文翻译资料
- 含锆金属有机框架和微波加热,将葡萄糖转化为5-羟甲基糠醛外文翻译资料
- 零价纳米铁颗粒和根际微生物对白柳植物修复能力的影响极其响应外文翻译资料
- 超声辅助深共晶溶剂萃取法绿色高效提取黄酮类化合物外文翻译资料
- 工业发酵过程中微生物竞争优势的代谢工程外文翻译资料
- w-转氨酶级联反应的最新进展外文翻译资料
- Bi2WO6微/纳米结构:合成、改性及可见光驱动光催化应用外文翻译资料
- 磷酸氧阴离子修饰的Bi2WO6/聚酰亚胺复合材料对四环素的太阳光催化降解外文翻译资料


