
英语原文共 9 页,剩余内容已隐藏,支付完成后下载完整资料
氧阴离子孔稳定立体定向异构化核糖-5-磷酸异构酶(Rpi)
摘要
核糖-5-磷酸异构酶(Rpi)是核糖-5-磷酸(R5P)与核酮糖-5-磷酸(R5P)相互转化的氧化还原戊糖-磷酸途径中的关键酶。我们测定了嗜热细菌HB8中Rpi与底物R5P的开链形式、C2外键抑制剂阿拉伯糖5-磷酸盐的开链形式以及高分辨率的载脂蛋白形式的配合物的晶体结构。两种配合物的晶体结构表明,这些开环差向异构体以镜对称的束缚模式束缚在活性位点上。O1原子是由保守序列中的主链酰胺类氮原子组成的氧化离子孔稳定的。在RpiR5P复合体的结构中,在排水环境中,顺式结构的O1-C1-C2-O2转化半径与Glu-108的羧基氧原子相互作用。此外,还推测C2羟基与赖氨酸-99侧链的短氢键高度极化。R5P作为开环反应的中间产物,澄清了催化剂的高立体选择性,并且与Rpi通过顺-烯二酸酯进行的醛酮糖转化相一致。
核糖-5-磷酸异构酶(Rpi1;EC5.3.1.6)在所有活细胞中普遍存在,在氨基酸序列中高度保守。Rpi作为氧化戊糖-磷酸循环中的关键酶,催化5-磷酸核糖(R5P)可逆转化为5-磷酸核酮糖(Ru5P)。此外,Rpi在光合作用有机体的还原戊糖-磷酸循环(卡尔文循环)中起着中心作用。Rpi催化葡萄糖-转化的最后一步6-磷酸核糖-5-磷酸,这是合成核苷酸所必需的。在卡尔文循环中,当加速器加入CO2时,在最后一步将R5P转化为Ru5P再生为1,5-二磷酸核酮糖。在戊糖-磷酸循环的非氧化途径中,R5P是5-磷酸核糖焦磷酸盐的前体,用于合成氨基酸如组氨酸和色氨酸、嘌呤和嘧啶、核苷和NAD(1),而Ru5P是核黄素前体(2)。在卡尔文循环中,Rpi与其他5种酶(核酮糖-1,5-二磷酸羧基酶/加氧酶(RuBisCO))形成功能性多酶复合物,在原位催化叶绿体类囊体膜上的连续反应(3)。Rpi催化反应的方向主要受R5P和Ru5P浓度的影响。
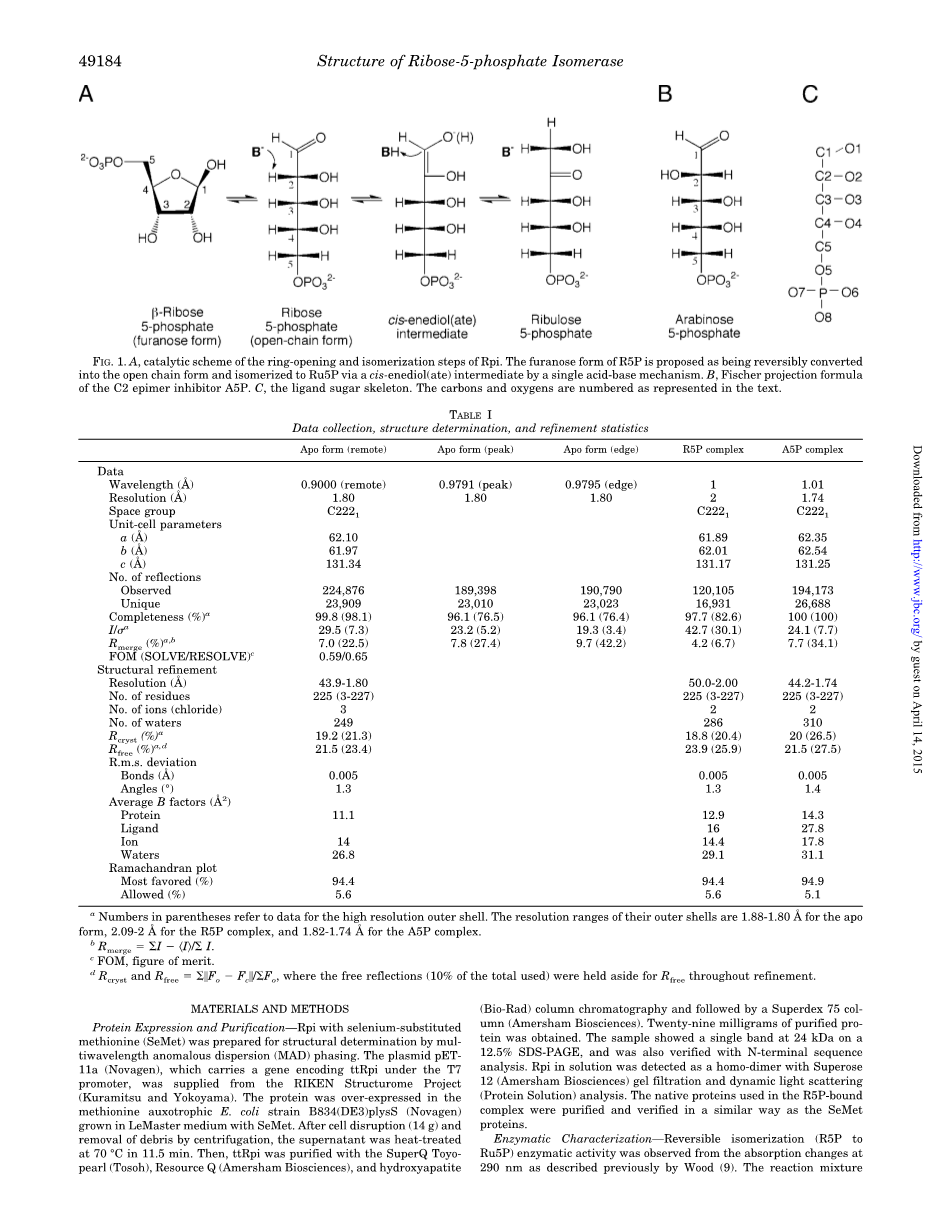
Rpi的催化机理(图1A)被认为是先在底物上形成一个环状开口,然后在开链形式上形成异构体。同位素交换研究表明,磷酸丙糖异构酶(TIM)、葡萄糖-6-磷酸异构酶(PGI)和Rpi在酮糖和醛糖之间的异构化过程包括底物C1和C2位置之间通过顺式烯二醇(ate)中间体(4,5)的质子转移。在催化反应中,转移质子在烯二醇(酯)结构中保持在平面的同一侧。然后,由一个碱基抽取的质子被返回到C1或C2位置,导致Ru5P转换为R5P,反之亦然(图1A)。
最近,大肠杆菌Rpi的apo和与b-异常呋喃糖形式的阿拉伯糖5-磷酸(A5P)的晶体结构已经被确定(7,8)。在此基础上,提出了一种开环机构。此外,还报道了来自超高温菌的一个四聚体Rpi的晶体结构,其晶体结构为apo形式,并与抑制剂4-磷酸糖醛酸(4-phosphoryth-ronicacid)形成复合物,从而阐明了该蛋白(25)的热稳定性。然而,到目前为止,关于Rpi的醛糖-酮糖异构化机理的结构信息还很少。
在这里,我们报道了Rpi的第一个晶体结构来自极端嗜热菌,嗜热细菌HB8,在2-分辨率和开环形式的基底R5P和开链形式的C2epinhibitorA5P在1.7分辨率(以下简称ttRpiR5P和ttRpiA5P复合物),以及载脂蛋白的形式在1.8分辨率。TtrpiR5P复合物的高分辨晶体结构表明,Rpi pro-ceeds通过顺式烯二酸盐中间体与带负电荷的O1(图1C)在氧阴离子孔的稳定下异构化。
图1 Rpi开环异构化反应的催化方案。提出R5P的呋喃糖形式是可逆地转化为开链形式,通过一个单一的酸碱机制使一个顺式烯二醇(酯)中间体异构化为Ru5P。2e型抑制剂A5P的费歇尔投影式公式,配体糖骨架。正文中列出了碳和氧原子的编号。
表一 数据收集、结构确定和求精统计
括号中的数字指的是高分辨率外壳的数据。其外壳的分辨率范围为apo型1.88-1.80,R5P型2.09-2,A5P型1.82-1.74。
物料及方法
用多波长反常色散相位法制备了蛋白质表达和纯化rpi,用于蛋白质结构的测定。质粒pET11a(Novagen)是由日本理化研究所结构工程(Kuramitsu和Yokoyama)提供的,携带ttRpi基因在T7启动子下。该蛋白在 LeMaster 培养基中高效表达,表达产物为蛋氨酸缺陷型大肠杆菌 B834(DE3)plysS(Novagen)。在细胞破碎(14g)和离心去除碎屑后,上清液在70°c下热处理11.5分钟。然后,用SuperQToyopearl(Tosoh)、Resourceq(AmershamBiosciences)、羟基磷灰石(Bio-Rad)柱色谱法和Superdex75(AmershamBiosciences)柱纯化ttRpi。获得29毫克纯化蛋白。样品在12.5%的SDS-PAGE上显示为24kDa的单一带,并且用n端序列分析进行了验证。用Superose12(AmershamBiosciences)凝胶过滤和动态光散射(ProteinSolution)分析,检测溶液中的Rpi为同二聚体。用于r5p结合复合物的天然蛋白被纯化,并以类似于SeMet蛋白的方式得到验证。
从Wood(9)在290nm处的吸收变化中观察到可逆异构化(R5P转化为Ru5P)的酶活性。反应混合物含有5nmRpi,0.1mNaCl和50mmHepes(ph7.5)。用R5P(Fluka)在50°c下0.5--30mm范围内测定吸收增加量。动力学参数由LineweaverBurk图计算,并通过三个独立测量值的平均值得到。在含有不同浓度A5P的测定液中,在50°c下测定A5P的抑制作用。Ki值是根据Dixon图计算出来的。
图2 Ttrpi的整体结构。A,Rpi载脂蛋白形式的二聚体,沿2倍晶体轴对称观察到的带状表征。一个子单元显示为天蓝色,另一个子单元显示为红色。四种氯离子(淡绿色)在二聚体界面上介导单体与单体的相互作用,而五氯离子(品红)则是载脂蛋白结构的独特之处。B,总体结构载脂蛋白形式的一个单体的Rpi。重点介绍了三个保守的配体结合序列,即磷酸盐结合p序列(27-34;绿色)、糖结合s序列(85-91;紫色)和催化c序列(98-110;红色)。C基序中的氧阴离子孔与氯离子(品红)结合,并以黄色突出显示。在空间填充模型中,相关蛋白之间的保守残基以柠檬黄色突出显示。Rpi保守配体结合基序与二级结构元件的序列比对。Ttrpi的配体结合序列与来自p.horikoshii(Swiss-ProtnumberO50083)、大肠杆菌 (SwissProtnumberP27252)、流感嗜血杆菌(Swiss-ProtnumberP44725)、菠菜(ProteinResearchFoundationnumber219421a)、人类(Swiss-ProtnumberP49247)、小鼠的相关酶结合(瑞士产品编号P47968)、酵母(Swiss-ProtnumberQ12189)和二级结构元件(即a-helices(矩形)和b-strands(箭头))。它们之间完全保守的残基用黄色突出显示,与R5P和A5P直接相互作用的残基用红色字母显示。P-、S-和C-的序列分别用绿色、紫色和红色的方框括起来。与氯离子结合所涉及的残基用序列上方的品红圈表示。氧离子孔(残基100-105)用黄色波浪线表示。
结晶与数据收集---利用日本理化研究所(11)新研制的全自动蛋白质结晶观测系统“TERA”,采用油批法(10)对SeMetRpi的结晶条件进行了筛选。以蛋白质10mg/ml、聚乙二醇4000、0.1mTrisHCl(ph8.4)、1mLiCl为原料,制备了晶体。晶体在18摄氏度的温度下一周内生长。晶体在20%(v/v)甘油中快速冷却。采用电荷耦合面探测器(RigakuJupitor210)在SPring-8的束流线BL45XUPX(12)处采集了晶体的x射线衍射数据,分辨率为100k到1.8。波长分别为0.900(远端),0.9791(峰值)和0.9795(边缘),晶体探测器距离为200毫米。晶体属于空间群C2221,其单胞参数分别为a62.10,b61.97,c131.34,其中一个分子位于空间群C2221中Vm值(13)为2.63/da的非对称单位。
将天然或SeMet衍生物晶体浸泡在含有10mmR5P(Fluka)或10mmA5P(Sigma)的溶液中,在15℃条件下浸泡14h,得到R5P结合或A5P结合的Rpi晶体。在波长为1的条件下对两种配合物进行了数据采集。Ttrpir5p和ttrpia5p配合物的晶体形态与未浸泡晶体相同,分辨率分别为2和1.7。所有衍射图像均使用程序HKL2000(14)进行处理、整合和缩放。
结构测定和精化---除n端外,所有硒位点均被发现和精化,并用SOLVE(15)和RESOLVE(16)程序计算了初始相。初始模型构建由arp/warp(17)自动完成,附加模型构建由O(18)手动完成。使用CNS(19)对模型进行精化。在精制过程中,水分子被分配,氯离子被确定为根据峰高和电子密度图中的位置判断。在1.8分辨率下,载脂蛋白形态的工作r因子为19.2%,自由r因子为21.5%。10%的数据集被选择用于自由r因子计算。
用AMoRe(20)程序用分子置换法求解了ttRpiR5P和ttRpiA5P配合物的晶体结构。利用量子化学程序生成的配体模型最初被用来拟合带有FoFc系数的电子密度图。Ttrpir5p配合物在2-分辨率下进行精制,工作r因子为18.8%,游离r因子为23.9%。Ttrpia5p配合物最终精制成分辨率为1.7,工作r因子为20.0%,自由r因子为21.5%。
用PROCHECK(21)程序验证了三种结构的模型质量,结果表明,所有主链扭转角都在允许的范围内。图2、a和b,以及图4、a和c,图5和图6是用MOLSCRIPT(22)和Raster3D(23)程序编制的。
图3 R5p结合带表面静电势的表示。活性位点上的结合R5P用一个透明的范德华表面的棒状模型表示。根据表面的静电势(红色为25kbt,蓝色为25kbt,其中kb为玻尔兹曼常数,t为绝对温度)对表面进行了颜色编码,并使用GRASP(24)程序进行了制备。Glu-108的侧链也用棍状模型表示,而主链则用实心管表示。
图4 Rpi的主动站点体系结构。A, ttRpi的apo形式的活性位点的特写视图。三个配体结合序列与活性位点残基侧链的表示为紫色的棒状模型。水分子以红色球体的形式显示,球体上标有数字w。与氧阴离子孔结合的氯离子(品红)显示为sA的FoFc电子密度图(5s),该图是在省略了模型中的相关部分后以1.8的分辨率计算出来的。3.4中的氢键相互作用用黑色折线表示,而Glu-108和Lys-99之间的氯离子和盐桥相互作用分别用橙色折线和绿色折线表示。TtrpiR5P复合物活性部位的特写镜头。5p的模型显示了FoFc省略的电子密度地图,3s计数器水平为淡蓝色,6s计数器水平为绿色,分辨率为2。R5p与活性位点残基之间以及活性位点残基本身之间的氢键相互作用在黑色中分别表现为粗线和细线。R5p的O1相互作用表示为橙色折线。TtrpiA5P复合物活性部位的特写镜头。A5p模型显示为省略的电子密度图,FoFc系数显示为2.8s计数器水平淡蓝色,6s计数器水平绿色,分辨率为1.7。在ttRpi的载脂蛋白形式与键长的活性位点中相互作用的示意图表示。氢键的距离用颜色表示法来区分(青色,在2.8之内;蓝色,在2.9和3.3之间;品红,长于3.4)。与氯离子的相互作用用橙色折线表示。在Lys-99和Glu-108之间的盐桥用绿色折线显示。TtrpiR5P复合物活性位点相互作用的示意图。
图5。表示结合R5P和A5P之间的重叠,显示两个配体的镜像结合模式。各种折线显示了残基与R5P作为顺式烯醇酯中间体的相互作用。橙色的虚线显示了文本中描述的O1和氧阴离子孔之间的相互作用。黑色的虚线包括了在Asp-86、Asp-89和Lys-99中所涉及的氢键相互作用。Glu -108的相互作用表现为粗的红色虚线。
图6。TtrpiR5P (青色)与TIMDHAP(品红)和TIMIPP(绿色)活性中心的比较。在Rpi活性位点中,显示了两个重要的催化残基Glu-108和Lys-99与R5P(红色折线)的相互作用,以及氧阴离子孔(黄色)的表示。将DHAP与TIM(品红)的几个活性位点残基(Asn-10,Lys-12,His-95,Glu-165)的相互作用表示为黑色折线。添加剂IPP配合物(淡绿色)的相应残基与添加剂DHAP配合物相叠加。
结果
ttRpi的表征---用于结晶的ttRpi样品显示出正常的酶活性。采用气相色谱-质谱联用技术,研究了ttRpi在前向反应中的动力学参数。以R5P为底物,在50℃条件下,ttRpi的动力学参数为kcat=107278s-1,Km=1.63plusmn;0.24m,kcat/Km=(6.64plusmn;0.91)x105M-1S-1。Ki值为0.89plusmn;0.14mM。这种酶的特性与先前报道的大肠杆菌和纺锤体蛋白的特性一致。
ttRpi的晶体结构证明ttRpi是一个均二聚体(图2A),这与通过凝胶过滤(Mr=47,300)和动态光散射测量(Mr=50,000)确定的溶液中蛋白质的分子量是一致的。这两种单体是通过结晶学上的二重对称性联系起来的。两个氯离子稳定了两个单体之间的紧密相互作用(图2A)。在Arg-193和Glu-197之间以及Asp-75和Arg146之间有一个疏水相互作用的侧链盐桥和一个水分子介导
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[419370],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 纳米材料介导镉污染土壤原位修复的机理及研究进展外文翻译资料
- 纳米零价铁磁洗受镉污染水稻土壤的有效性验证外文翻译资料
- 镉对水稻叶片生长和养分运输的短期影响外文翻译资料
- 间接竞争ELISA的研制及可视化基于金纳米棒生长的多色酶联免疫吸附试验玉米赤霉烯酮的测定外文翻译资料
- 铅(Pb)诱导的小麦根系生化和超微结构变化外文翻译资料
- 用蚕豆根尖微核试验评估污水灌溉区和生物修复区土壤的遗传毒性外文翻译资料
- 镧在红土壤中的生物累积和其对玉米幼苗生长的影响外文翻译资料
- 铈对水稻幼苗生长及部分抗氧化代谢的影响外文翻译资料
- 用黄体孢子菌沉淀碳酸盐固定有毒金属的体外研究及其在含硫化物尾矿中的应用外文翻译资料
- 水牛妊娠早期生物标志物的编码序列克隆及部分序列密码优化后在大肠杆菌中的表达外文翻译资料


