A bHLH regulatory gene in the common morning glory, Ipomoea purpurea, controls anthocyanin biosynthesis in flowers, proanthocyanidin and phytomelanin pigmentation in seeds, and seed trichome formation 普通圆叶牵牛花中的bHLH调节基因,控制花中的花青素生物合成,原花青素和种子中的植物黑素色素沉着,以及种子毛状体形成
原文作者 Kyeung-Il Park, Naoko Ishikawa, Yasumasa Morita, Jeong-Doo Choidagger;, Atsushi Hoshino and Shigeru Iida*
单位 National Institute for Basic Biology, Okazaki 444-8585, Japan
摘要:花青素色素沉着的转录调节因子含有R2R3-MYB结构域,bHLH结构域和保守的WD40重复序列的蛋白质,它们的相互作用决定了待表达的基因组。显示浅色花和象牙色种子的圆叶牵牛的自发象牙色种子(ivs)突变体是由DNA转座子插入编码bHLH转录调节因子的bHLH2基因引起的。在这些ivs突变体的幼花芽中观察到编码花色素苷生物合成酶的所有结构基因的表达的部分降低。 DFR-B和ANS转录物在ivs种皮中完全消除,而黄酮醇生物合成的早期生物合成基因保持活性。象牙色种皮中原花色素和植物黑素素颜料的产生和积累显着减少。此外,象牙色种子中的未分枝毛状体尺寸较小,数量少于野生型深棕色种子,而深棕色种子中没有毛状体的表皮表面由于突出而看起来更粗糙。虽然圆叶牵牛花bHLH2基因与矮牵牛AN1基因关系最密切,已知其突变赋予白花并且缺乏其液泡的酸化,但是圆叶牵牛花ivs突变体的表皮花枝中的液泡碱化似乎正常发生。本文讨论了关于bHLH转录调节因子控制花和种子色素沉着以及其他表皮性状的功能的结果。
关键词: bHLH转录调节因子,圆叶牵牛,花青素色素沉着,原花青素生物合成,植物黑素积累,毛状体形成。
前言
番薯属包括在全球范围内分布的约600种物种,其表现出各种花形态和色素沉着模式;在美洲,特别是在墨西哥,发现大量的牵牛花(Austin and Hua ́ man, 1996; Clegg and Durbin, 2003)。其中,三种牵牛花,裂叶牵牛花(the Japanese morning glory ) ,圆叶牵牛花(he common morning glory) 和三色牵牛花,已经成功地将其作为花卉植物驯化,并且已经分离出许多赋予各种花色素沉着表型的突变体;自17世纪以来分别在日本和欧洲已经分离和培养了具有各种花色的裂叶牵牛花和圆叶牵牛花的自发突变体,这种三色牵牛花的突变体在20世纪中叶在北美被分离出来(Iida et al., 1999; White, 1981) 。裂叶牵牛花和三色牵牛花都是蓝色花朵,而圆叶牵牛花产生深紫色花朵(图 1a) ,它们都含有多酰化和聚糖基化的基于氰基的花青素(Kondo et al., 1987; Lu et al., 1992; Saito et al., 1995) 。编码酶以产生花色素3-O-槐糖苷的所有结构基因已经在这些裂叶牵牛花中被表现(图 2) ,并且它们的大多数自发突变已被证明是由DNA转座子的插入引起的。这包括Tpn1及其在裂叶牵牛花的CACTA超家族中的亲属,以及来自圆叶牵牛花的hAT超家族的Tip100和Tip201(Chopra et al., 2006; Durbin et al., 2000, 2001; Fukada-Tanaka et al., 1997; Habu et al., 1998; Hisatomi et al., 1997; Hoshino et al., 1997, 2002; Johzuka-Hisatomi et al., 1999; Morita et al., 2005; A. Hoshino and Y. Morita, unpublished data)。在圆叶牵牛花中,Tip100插入CHS-D基因通常导致带有彩色片的白色花(Durbin et al., 2001; Habu et al., 1998) ,而Tip201整合到F3rsquo;H基因中则赋予了稳定的红色花朵(Hoshino et al., 2003) 。尽管Mutator家族的InMu1也在裂叶牵牛花的CHI基因的内含子2中被发现,但似乎没有表型效应(Hoshino et al., 2001)。双子叶植物花色素沉着的结构基因可分为黄酮和/或黄酮醇生物合成的早期生物合成基(EBGs)和花青素生物合成的晚期生物合成基因(LBGs),包括DFR和ANS(图2), 而单子叶玉米(Zea mays)中的花色素苷色素沉着似乎作为单一模块协调调节而不分离EBGs和LBGs(Martin and Gerats, 1993; Mol et al., 1998; Schwinn and Davies, 2004) 。
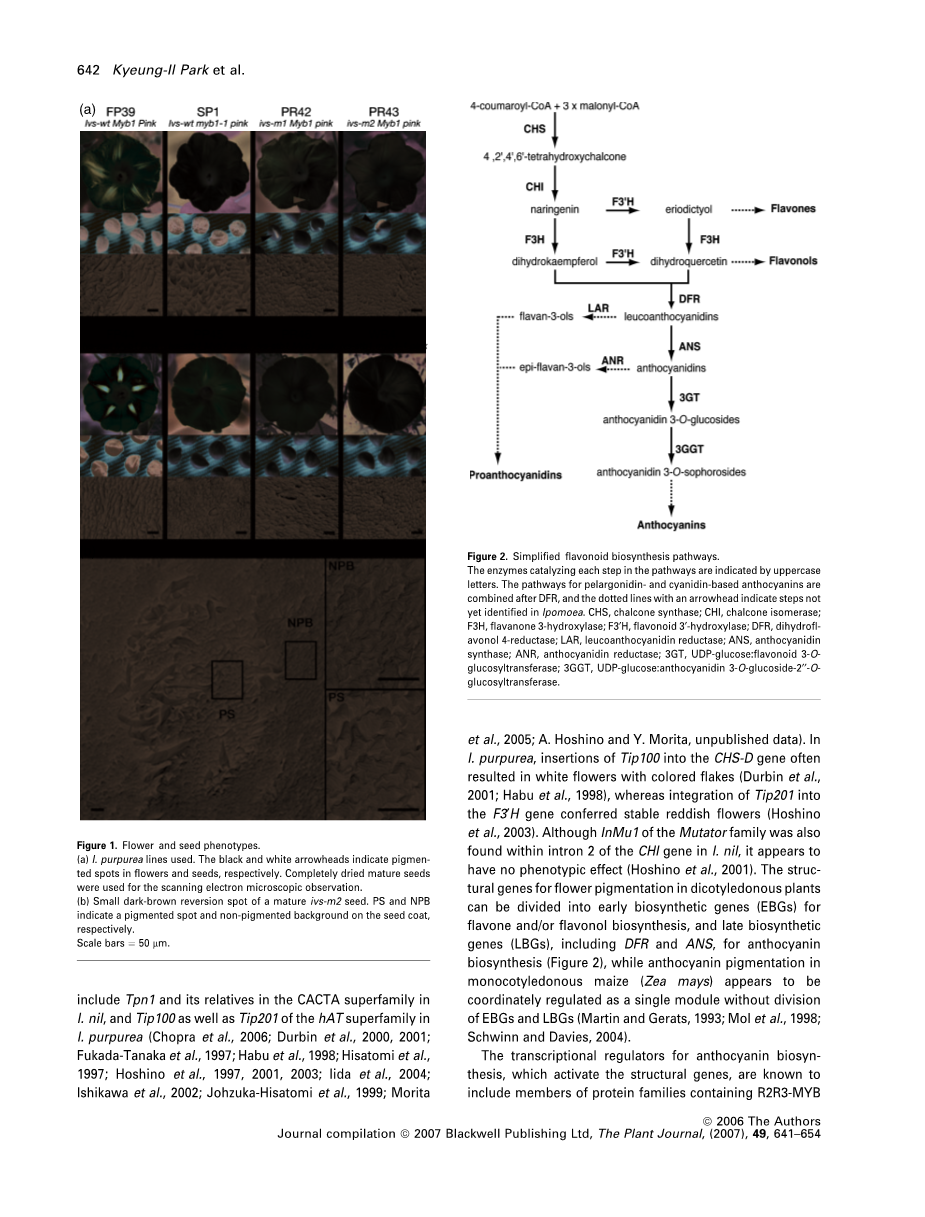
图2.简化的类黄酮生物合成途径。
催化通路中每个步骤的酶用大写字母表示。 基于天竺葵素和花青素的花青素的途径在DFR后组合,带箭头的虚线表示在番薯中尚未鉴定的步骤。 CHS,查尔酮合成酶; CHI,查尔酮异构酶; F3H,黄烷酮3-羟化酶; F3cent;H,类黄酮3rsquo;- 羟化酶; DFR,二氢福尔醇 - 还原酶; LAR,隐色花青素还原酶; ANS,花青素合成酶; ANR,花青素还原酶; 3GT,UDP-葡萄糖:类黄酮3-O-葡糖基转移酶; 3GGT,UDP-葡萄糖:花色素3-O-葡萄糖苷-2-O-葡糖基转移酶。
图1.花和种子表型。
(a)使用的圆叶牵牛系。 黑色和白色箭头分别表示花和种子中的斑点。 完全干燥的成熟种子用于扫描电子显微镜观察。
(b)成熟的ivs-m2种子的小的深棕色回复斑点。 PS和NPB分别表示种皮上的色素斑和非色素沉着的背景。比例尺=50微米
已知花青素生物合成的激活结构基因的转录调节因子包括含R2R3-MYB结构域的蛋白质家族成员。bHLH(碱性螺旋 - 环 - 螺旋)结构域和保守的WDR(WD40重复);R2R3-MYB,bHLH和WDR因子的组合及其相互作用决定了待表达的基因组(Broun, 2005; Irani et al., 2003; Koes et al., 2005; Mol et al., 1998; Ramsay and Glover, 2005) 。紫红色的隐性白色突变体,呈现白色花朵,每条射线都有着色斑点(Ennos and Clegg, 1983),它也被Imai(1927)指定为“斑点花”,携带对R2R3-MYB,IpMYB1 / W的基因进行小的缺失(Chang et al., 2005) 。这与矮牵牛(Petunia hybrida)AN2基因密切相关(Quattrocchio et al., 1999) 。在裂叶牵牛花中,显示白花的隐性c-1突变体在R2R3-MYB的基因中携带移码突变,InMYB1 / C-1与IpMYB1 / W(Morita et al., 2006)。bHLH基因突变,矮牵牛an1和拟南芥(Arabidopsis thaliana) ,gl3和egl3最密切相关,不仅影响花青素沉着以及其他表皮特征,如种皮细胞中的细胞形态和叶片中的毛状体形成,以及WDR基因,矮牵牛an11和拟南芥ttg1中的细胞形态,赋予相似的表型(Spelt et al., 2002; Walker et al., 1999; Zhang et al., 2003)。R2R3-MYB,bHLH和WDR因子的相互作用对于表皮细胞类型的发展是必需的,包括毛状体形成(Larkin et al., 2003) ,在裂叶牵牛花中,带有白色种子的雪白花的隐性ca突变体在WDR,InWDR1基因中携带7 bp插入突变,并显示种子中毛状体形成减少(Morita et al., 2006) 。由于在矮牵牛中不仅AN1而且JAF13编码用于花色素苷生物合成的bHLH转录调节因子,AN1和JAF13蛋白分别被命名为bHLH2和bHLH1(Koes et al., 2005; Mol et al., 1998) 。还鉴定了来自裂叶牵牛花和圆叶牵牛花的bHLH2和bHLH1 cDNA(Morita et al., 2006) 。三色牵牛花中的可变ivs等位基因,赋予淡蓝色花朵,带有一些细小的蓝色斑点和具有微小深棕色斑点的象牙色种子,是由bHLH2基因的基因内串联重复引起的(Park et al., 2004) 。
在这里,我们显示,由于插入了Mutator家族的Tip100或IpMu元件,显示淡色素花和种子的自发圆叶牵牛花突变体缺乏bHLH2,并且显示雪白花的圆叶牵牛花突变体和含有bHLH2和MYB1基因突变象牙色种子。在这些突变体中,用于花色的花色素苷生物合成减少,种子色素沉着中原花青素生物合成的LBGs的表达被消除,并且用于种子色素沉着以及种子毛状体形成的植物黑素的生物合成和/或积累减少。我们还讨论了控制裂叶牵牛花中各种表皮特征的转录调节因子的功能,这可以作为模式植物,为基因调控的研究提供实验多样性。
结果
圆叶牵牛花突变体表现出白花和象牙色种子
虽然野生型圆叶牵牛花植物FP39产生完全紫色的花和深棕色种子(图1a),但已鉴定出两个显示白色花和正常颜色种子的圆叶牵牛花基因座的隐性突变:在CHS-D内含子中插入两份Tip100产生白色花朵(Habu et al., 1998) ,在MYB1(白色或myb1-1等位基因)中引起移码的两个6bp和19bp缺失赋予在每个光线中有一个彩色斑点的白色花朵(Chang et al., 2005)。我们确认在我们的集合中的SP1系植物显示具有红色斑点的类似白花(图1a)含有相同的myb1-1等位基因(数据未显示)。表征象牙色种子的圆叶牵牛花的自发突变,因为它们的表型与bHLH2基因中具有可变的ivs等位基因的三色牵牛花突变体的表型相似(Park et al., 2004) ,我们使用了五种ivs突变体,PR42,PR43,PP45,PR46和WR4。其中,可变ivs(ivs-m)品系PR42和PR43的植物是单株植物的后代(见实验程序),带有具有细红斑点的浅红色花朵和具有微小深棕色斑点的象牙色种子, 而稳定的ivs(ivs-stb)突变体PP45和PR46分别呈现出淡紫色和淡红色的花和象牙色种子(图1a)。这些ivs-stb突变体和FP44(赋予明显的野生型表型)是产生紫色花和深棕色种子的单一植物的分离物(参见实验程序),PP45和PR46的紫色和红色花朵着色是由于 F3rsquo;H基因分别带有Pink和pink (由于Tip201插入; Hoshino et al., 2003)等位基因(图1a;数据未显示)。尽管WR4含有myb1-1等位基因(数据未显示),但其单独的myb1-1等位基因无法解释其稳定的白花和象牙色种子的表型,因为已知myb1-1赋予白花每个射线和正常颜色种子的色素斑,如SP1所示(图1a)。因此,我们假设WR4也可能携带额外的ivs突变。
众所周知,bHLH基因中的拟南芥和矮牵牛突变不仅影响花青素色素,还影响其他表皮特征,如拟南芥叶片中的毛状体形成和矮牵牛种皮的细胞形态(Spelt et al., 2002; Zhang et al., 2003),我们检查了ivs突变是否会带来类似的缺陷。在圆叶牵牛花中,在叶和茎中形成的毛状体在野生型和ivs突变体之间难以区分(数据未显示)。然而,就像缺乏IpWDR1的裂叶牵牛花 ca突变体中的白色种子一样(Morita et al., 2006) ,ivs种子的毛状体尺寸较小,数量明显少于野生型系FP39,一种明显的野
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 14 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[278931],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 纳米材料介导镉污染土壤原位修复的机理及研究进展外文翻译资料
- 纳米零价铁磁洗受镉污染水稻土壤的有效性验证外文翻译资料
- 镉对水稻叶片生长和养分运输的短期影响外文翻译资料
- 间接竞争ELISA的研制及可视化基于金纳米棒生长的多色酶联免疫吸附试验玉米赤霉烯酮的测定外文翻译资料
- 铅(Pb)诱导的小麦根系生化和超微结构变化外文翻译资料
- 用蚕豆根尖微核试验评估污水灌溉区和生物修复区土壤的遗传毒性外文翻译资料
- 镧在红土壤中的生物累积和其对玉米幼苗生长的影响外文翻译资料
- 铈对水稻幼苗生长及部分抗氧化代谢的影响外文翻译资料
- 用黄体孢子菌沉淀碳酸盐固定有毒金属的体外研究及其在含硫化物尾矿中的应用外文翻译资料
- 水牛妊娠早期生物标志物的编码序列克隆及部分序列密码优化后在大肠杆菌中的表达外文翻译资料


