通过负载盐酸青藤碱的抗氧化剂表面透过体增强类风湿性关节炎的透皮渗透性和药物沉积
Song Hui 北京协和医学院药物研究所北京市药物传递技术及新剂型重点实验室
背景:透皮给药系统(TDDS)治疗类风湿性关节炎(RA)需要长期治疗,可以提高患者依从性,减少药物副作用的积累。然而,由于角质层的紧密连接和低渗透效率,使得TDDS效应受到限制。应采用适当的渗透方法,以确保治疗效果。穿索小体(TE)来源于转小体和醇质体(E),含有高含量的乙醇以及边缘活化剂或渗透促进剂,具有优异的变形能力和较高的渗透效率。
方法与结果:本研究采用抗坏血酸修饰盐酸青藤碱负载的TE,形成抗氧化表面转运体(AS-TE)。结果表明,含去氧胆酸钠的TE和AS-TE均能有效提高亲水性药物的包封率,且具有比E组更优越的变形能力和更高的渗透效率。兔血浆药代动力学研究表明,TE组和AS-TE组血药浓度和生物利用度相近;而对滑液的微透析则显示AS-TE组药物浓度较高。在RA大鼠模型中,AS-TE组在3周治疗中对关节肿胀的缓解更明显。炎性细胞因子及红细胞沉降率均明显低于阴性对照组和TE1组。
结论:AS-TE可针对RA的氧化剂应激增加透皮吸收和药物沉积,具有作为RA的TDDS因子的进一步研究潜力。
关键词:透皮给药系统;抗氧化表面;穿索体;氧化剂压力;微透析
介绍
类风湿性关节炎(RA)是一种以多系统炎症、自身抗体变化为特征的慢性疾病。1在成年人中的发生率占0.5 ~ 1.0%以内,女性发生率比男性高2 ~ 3倍。2在治疗有限且预后不良的情况下,失控的RA可能导致损伤、残疾、心血管疾病和其他并发症,降低生活质量。因此,RA是可导致关节变形移位的疾病之一,甚至可影响全身。2
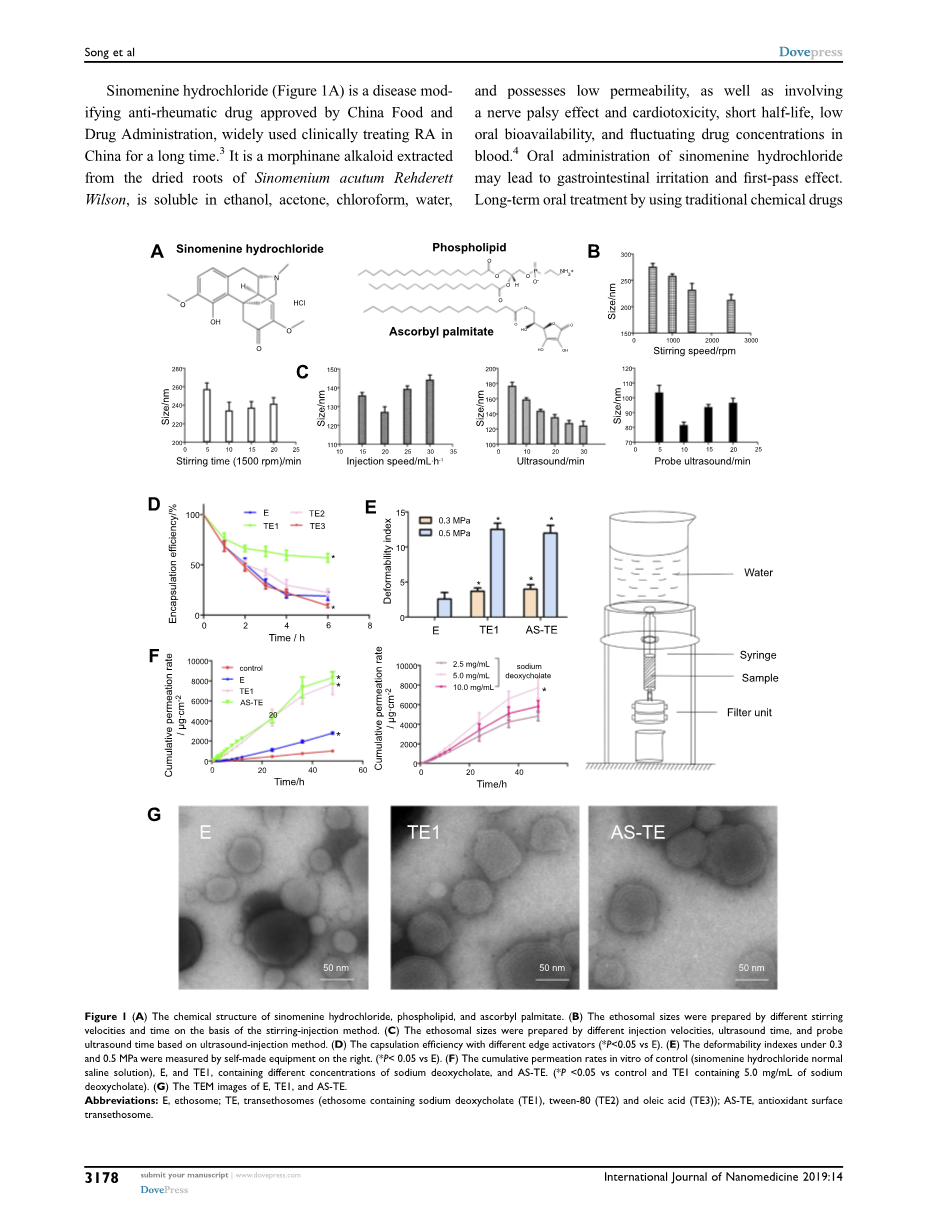
盐酸青藤碱(图1A)是经中国食品药品监督管理局批准的一种疾病修饰性抗风湿药物,长期以来在我国临床广泛用于RA的治疗。3它是从青藤干燥根中提取的吗啡喃生物碱,易溶于乙醇、丙酮、氯仿、水,并且具有渗透性低,神经麻痹效应、心脏毒性,半衰期短,口服生物利用度低,血药浓度波动的特点。4口服盐酸青藤碱可导致胃肠道刺激和首过效应。使用传统的化学药物长期口服(如盐酸青藤碱)可能会导致毒性的累积和副作用,一些透皮制剂已经被成功开发出来以克服这些问题,并且早期的研究已经证实了透皮给药的可行性。5,6 TDDS作为一种非侵入性给药方法,可以防止首过效应和胃肠道刺激。TDDS可减少给药次数,维持治疗窗口期血药浓度持续释放,有利于RA的长期治疗。然而,角质层的紧密连接阻碍药物自由渗透到体内。一般认为分子量小于500 Da、Log P为3~5的药物容易通过皮肤渗透到体内。7,8随着纳米技术的发展,纳米载体在TDDS的应用越来越多。Touitou等制备了醇质体(E),即含有高含量乙醇(20-50%)的具有优异的变形性的纳米载体,乙醇也可以用作化学渗透增强剂。9 Transfersome是德国公司IDEAAG注册的商标,指的是其专有的药物递送技术。载体聚集体由至少一种两亲物组成,两亲物在水性溶剂中自组装成脂质双层,脂质双层封闭成简单的脂质囊泡。通过添加至少一种双层软化组分,脂质双层的柔韧性和渗透性大大增加。10然后,衍生自传递体和醇质体的穿索小体(TE)含有高含量的乙醇以及边缘活化剂或渗透增强剂,对于亲水性药物具有比醇质体和传递体更大的变形性和包封效率(EE)。11
氧化应激反映了活性氧(ROS)的全身表现与生物系统快速解毒反应性中间体或修复所导致损伤的能力之间的失衡关系。各种细胞均能耐受轻度氧化应激,因为它们具有作为修复系统的抗氧化防御能力,并能识别和去除被氧化损伤的分子,包括抗氧化酶和非酶营养素。12 Jukanti等利用抗氧化非酶营养素抗坏血酸和辅酶Q10,设计了两种靶向炎症部位的脂质体。在高水平ROS存在下,抗氧化表面脂质体可通过氧化还原相互作用优先定位于炎性部位。13本论文采用抗坏血酸修饰负载盐酸青藤碱的TE,形成抗氧化表面穿索小体(AS-TE),可能增强透皮渗透性和药物沉积。
材料和动物
盐酸青藤碱购自Ark Pharm,Inc.(Chicago, IL, USA)。大豆卵磷脂S100购自Lilipid GmbH。(Ludwigshafen, Germany)。脱氧胆酸钠、吐温-80、油酸、Na2S和三乙醇胺购自Beijing Innochem Science amp; Technology Co., Ltd。(Beijing, China)。抗坏血酸棕榈酸酯购自Alfa Aesar Co.,Ltd (Heysham, UK);戊巴比妥钠购自Huaxia Reagent (Chengdu, China);鸡蛋蛋白购自Acros Organics (Belgium);完全弗氏佐剂(CFA)购自Sigma–Aldrich Corporation (St. Louis, MO, USA);卡波姆941购自Beijing Fengli Jingqiu Pharmaceutical Co., Ltd. (Beijing, China)。大鼠肿瘤坏死因子alpha;(TNF-alpha;)、白细胞介素6 (IL-6)和活性氧酶联免疫试剂盒购自Shanghai Enzyme-linked Biotechnology Co., Ltd. (Shanghai, China)。所有其他试剂均经过分析分级,无需进一步纯化即可使用。
新西兰兔和斯普拉格-道利鼠购自Beijing Vital River Laboratory Animal Technology Co., Ltd. (Beijing, China)。所有动物均按照中国医学科学院amp;北京协和医科大学制定并经中国医学科学院amp;北京协和医科大学药物研究所实验动物管理委员会批准的实验方案进行使用和护理。
方法
E、TE和AS-TE的制备
超声引导注射法制备E、TE、AS-TE。具体处方见表1。将规定量的大豆卵磷脂S100、盐酸青藤碱和无水乙醇加入到用橡胶塞密封的锥形瓶中。使用注射泵(HK-400I, Shenzhen Hawk Medicinal Instrument Co., Ltd., Shenzhen, Guangdong, China)以20mL·h-1的速率在40 kHz超声下使用超声波清洗器 (ZQ-250DE, Kunshan Ultrasonic Instrument Co., Ltd, Jiangsu, China)向锥形瓶中注入规定量的蒸馏水。注射完成后,继续超声10min,将样品转移至冰浴下的超声细胞破裂仪((ZQ-150Y, Shanghai Zhengqiao Scientific Instrument Co., Ltd,Shanghai, China)中10min。样品经0.22um过滤器过滤,4℃储存。TE和AS-TE的制备工艺几乎相同。将edge活化剂或抗坏血酸棕榈酸酯与大豆卵磷脂S100和盐酸青藤碱共溶于无水乙醇中,并继续上述步骤。
E、TE和AS-TE的表征
使用激光粒度分析仪(Malvern Zetasizer Nano ZS, Malvern Instruments Ltd., Worcestershire, UK)测量粒度和zeta;电势。使用透射电子显微镜(TEM, HT7700, Hitachi, Japan)进行形态学检查,通过将一滴水性样品浇铸到碳包覆的铜网格上,并用2.0%磷钨酸进行阳性染色,从而制备出用TEM测试的样品。采用透析法测定纳米载体中盐酸青藤碱的截留量。然后,将1mL样本加入一个5 cm3,500Da的透析袋中,在100 rpm转速搅拌下将其加入到500mL蒸馏水中。对于每个实验,以预定时间间隔(0.5、1、2、3、4、5和6h)取样5mL透析培养基,然后立即将相同体积的纯培养基加入烧杯中。所有样本均通过0.22um滤膜过滤,并通过高效液相色谱(HPLC)进行分析。
盐酸青藤碱的定量采用Agilent 1100系列HPLC系统,该系统配有Agilent 1200系列DAD检测器和反相C18色谱柱(4.6 mmtimes;250 mm, 5um, Dikma)。使用Agilent chem station LC 3D系统采集软件采集和处理数据。流动相为甲醇和0.5%乙二胺水溶液(60:40,v/v)的混合物,流速为1.0mL/min。在276nm检测到流出物。该方法的选择性、线性度、检测限(30ng bull;mL-1)和定量(94ngbull;mL-1)、准确度、精密度和重复性均经过验证。
变形能力指数测定
变形能力指数由等式定义,表征纳米载体的可变形性,通过如前所述的挤出方法和自制设备测量(图1E)。14简单地说,通过Whatman 50nm Nuclepore聚碳酸酯轨道蚀刻膜过滤器(Whatman, UK)分别施加0.3和0.5MPa的压力,各自用15和5min挤出纳米载体。
其中E表示囊泡双层的变形性指数;j是通过膜过滤器的渗透速率(在5或15min内挤出的悬浮液的重量);rv代表囊泡大小(挤出后);rp表示膜的孔径。
体外皮肤渗透和沉积研究
将约200g斯普拉格-道利鼠的腹部毛发剃光,腹部皮肤用Na2S溶液轻轻地处理。24h后,处死大鼠,迅速切除腹部皮肤并去除皮下组织。切取的皮肤用生理盐水洗涤,在-20℃保存,在37.0℃下使用有效扩散面积为2.0cm2的ValiaChien扩散池 (TP-6, Tianjin Xinzhou Technology Co., Ltd., China)进行体外皮肤渗透和沉积研究。切除的皮肤样本夹在扩散细胞的供体和受体室之间,角质层(SC)面向供体室。将7mL含不同浓度脱氧胆酸钠的E、TE水溶液和AS-TE (1mL等于5mg盐酸青藤碱)涂于供体室。受体室充满7mL生理盐水。在整个实验过程中,以400rpm的转速搅拌受体培养基。对于每个实验,在受体培养基中以预定的时间间隔(0.5、1、2、3、4、5、6、8、10、12、24、36和48h)取样1mL,然后立即将相同体积的纯培养基加入受体室。所有样本均通过0.22um滤膜过滤,并采用3.2HPLC法进行分析。
皮肤渗透实验48h后,用甲醇洗涤皮肤标本表面5次,除去皮肤结合制剂和药物。分离皮肤有效表面积,用玻璃纸胶带 (3M Company, St. Paul, MN, USA)剥离SC层20次。 通过用甲醇从胶带中提取药物来测定SC中的药物含量。使用高速匀浆器(FA-25, FLUKO, Germany)以20,000 rpm的转速在冰浴(0°C)上匀浆5min,最终将剩余的表皮/真皮层在装有甲醇(1mL·cm-2)的小瓶中匀浆。将组织悬液以10,000 rpm(TGL-16G, Shanghai Anting Scientific Instrument Factory, China)离心5min,过滤上清液,采用3.2HPLC法测定盐酸青藤碱含量。
家兔血浆药物动力学
将2.5g卡波姆941加入50mL蒸馏水中并保持过夜。在搅拌下将三乙醇胺逐滴加入卡波姆中,直至形成无色透明半固体凝胶。将等体积的卡波姆凝胶和制剂混合物以5000rmp/min离心30min(H1850, Hunan Xiangyi Laboratory Instrument Development Co. Ltd., China),以去除气泡。然后得到含2.5mg·mL-1纳米载体的半固体凝胶。
本实验选择健康的日本白兔(雄性,2.0plusmn;0.5kg),在配方给药前将它们后膝的毛发剃掉。将兔随机分为对照组(盐酸青藤碱溶液凝胶),i.g.组,TE1组、AS-TE组(每组各3只)。i.g.组接受5mg·kg-1的灌胃给药。AS-TE组接受剂量为5mg·kg-1经皮给药,将凝胶均匀涂抹在后膝关节部位。本管理区域采用SCOTCHPAKTM聚酯膜(3M, St. Paul, MN, USA)覆盖,医用胶带(Qingdao Hainuo Biological Engineering Co., Ltd., China)固定。另一组兔以相同的手术方法和剂量进行对照和TE1注射。在给药后2、4、6、8、10、12、24、36和48h的预定时间点,从耳缘静脉采集1.0mL血液样本,并移至含有肝素钠的离心管中。以3,000 rpm的转速对所有血样离心10min。分离上清液,立即在–80℃的深冷冻机中冷冻,直至分析。同时采用HPLC法测定血浆样本中盐酸青藤碱的含量。
采用液-液萃取法对血浆样本中的盐酸青藤碱进行提取。简言之,向离心管中的血浆样本(400uL)中加入200uL的氨-氯化铵溶液(pH =11.0)。将试管涡旋2min,然后加入4mL乙酸乙酯作为提取溶剂。涡旋混合5min后,以5,000 rpm的转速将混合物离心10min。然后分离有机层,并在50℃氮气流下蒸发至干燥(DC-24 nitrogen blowing
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 12 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[270842],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 下游产品是硫酸乙酰肝素2-0-磺基转移酶的有效抑制剂外文翻译资料
- 奥希替尼的耐药性不断发展的格局外文翻译资料
- 伪五山淫羊隆区域特异性鼠李糖基转移酶催化丙烯醇的3-阿霉素酰化 反应外文翻译资料
- 标记化合物和放射性药物杂志外文翻译资料
- 脂肪酶大规模分离水飞蓟宾非对映异构体外文翻译资料
- 钯催化萘胺与二芳基二硫化物和二硒醚的 C-H键裂解近选择性加成反应外文翻译资料
- 铜催化,定向基团辅助氟化芳烃和异芳烃碳氢键外文翻译资料
- Talin1通过局灶性粘附信号和失巢凋亡抵抗促进肿瘤侵袭和转移。外文翻译资料
- 杜氏肌营养不良综合征中的外显子跳跃外文翻译资料
- 来源于红树林内生菌稀有的细菌产caryolanes类代谢产物Bacaryolanes A−C外文翻译资料


