
英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
用于活细胞的量子点材料在活体成像与诊断中的应用
荧光显微术在分辨力、敏感度,功能性等方面的提高以及荧光传感器和蛋白质标记技术的发展使得我们对细胞内网络中的现象,胞内信号传导以及胞间作用等的动力学过程有了更清晰的理解。然而,想要完成阐明蛋白质在生物体内的功能和它们之间相互的联系(即完成蛋白质组以及相互作用组)这一任务量极大的目标,我们需要新的方法和工具。单分子法将在这场探索中扮演主要角色,但现有的体外技术想在复杂的细胞内环境中使用的话需要非常多的改进。荧光显微术有两大问题,一是由于细胞会自发辐射可见光光谱范围内的荧光,这种荧光会覆盖已标记分子发出的信号,第二是其所需的可持续观测时间较长。这两大问题使得我们需要新的能发出远红外光的探针,发射远红外光的物质相对于现有的有机荧光团有更好的成像能力。
量子点的特性
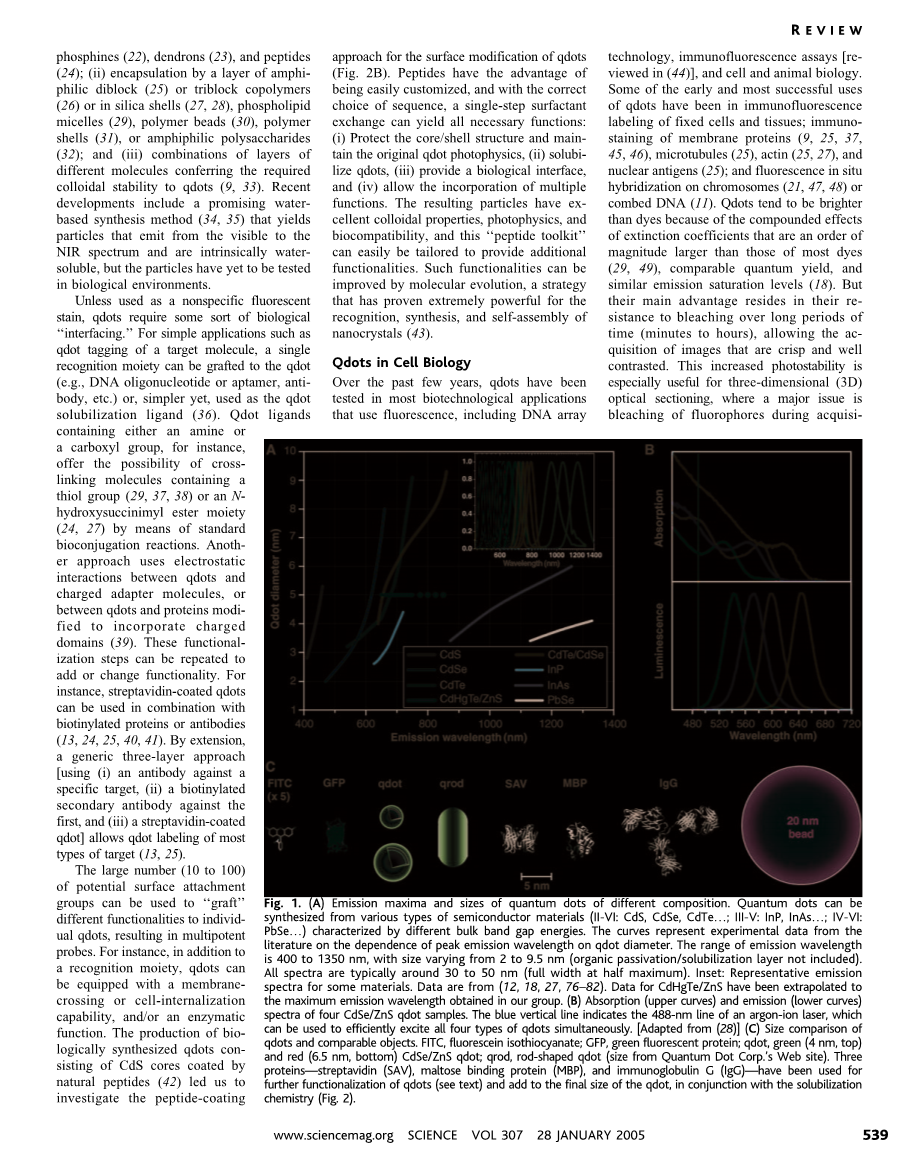
因为一些特性,量子点与常用的荧光团有明显的不同。胶体状的半导体量子点是一种直径几个纳米的单晶材料,它的粒径可以通过改变合成时的时间,温度,以及配体分子的种类来精确控制。合成得到的量子点材料对光子进行吸收与放出,且这一过程依赖于材料结构和尺寸。半导体吸收能量比能带间隙能量高的光子会产生电子-空穴对(或激发),高能量的光子(短波长光)更有可能被吸收,吸收后产生宽波段吸收光谱,这和传统的荧光团比有很明显的差异。由于纳米晶比所谓的波尔激发半径(约几纳米)要小,因此能级量子化,且能级能量明显与材料尺寸相关(这被称作量子限制效应,因此这种材料有了量子点这一名字)。激发过程中射线(光子)的再次结合(持续时间有10ns以上之久,十分特别)使得狭窄而又对称的能带发出光子,这是与发出短时间近红外的大部分荧光团的另一不同。量子点较长的荧光持续时间使其可以用于时间选通探测从而将它的信号从别的短寿命信号分出来(比如细胞中自发的背景荧光)。
表面缺陷在晶体结构中扮演临时俘获电子或空穴的“陷阱”,这阻止它们的再复合。俘获和释放过程的交替进行产生了间歇的荧光(闪烁),这在单分子尺度上可见并会降低总体的量子输出(释放与吸收的光子数比值)。解决这一问题并且避免表面原子被氧化或发生其他化学反应的方法是在纳米晶核外长一层几个原子厚、带间隙很大的层状材料。这个材料层通过小心设计可以把量子输出提高到90%,这一步还把量子点的成像能力增强到了传统染料成像能力几个数量级倍数的水平。
单个量子点能通过共焦显微术,全内反射显微术,或基础的广域荧光显微术来在很长时间内观测与追踪(长达数小时)。量子点的单分子研究揭示了整个测量过程中隐藏的现象,如闪烁,光谱上的跳跃,以及有时荧光效应会持续几倍的时间等。单分子显微术可能是现在最令人兴奋的能提供给生物学家们的手段了,我们将在后文讨论它。荧光相关谱这一技术让我们能确定每个量子点的亮度,还提供了一种测量量子点大小的方法。
量子点还是一种用于双光子共焦显微术的极好的探测用材料,因为它能吸收很宽频段的光。很自然地,量子点能和传统染料一起使用,而且,它还可以用作可定制的能量供给器(通过荧光共振能量传递),这有巨大的未开发的潜力。
量子点的增溶和官能化
量子点大多在无极性有机溶剂中合成,如果想让它溶解于水性缓冲液中,就必须要把量子点表面的疏水配位基替换成亲水基团。不同的量子点的增溶手段在过去几年内开发出来,包括用巯基配位取代,还有用低聚磷化氢,树枝状分子以及多肽等亲水性更强的基团取代;用双或三嵌段共聚物,二氧化硅外壳,亲水胶束,聚合物微球,高分子外壳,亲水多聚糖将量子点材料包裹起来;或用不同分子组成的分子层覆盖从而给予量子点需要的胶体稳定性。最近有一些新的进展,有人研发出一种很受推崇的水相合成法,这种方法产出的量子点能发出近红外段光且完全水溶,但还没有应用于生物环境。 除非不用于特定荧光染色,量子点需要一些生物的“衬布”。在一些简单的应用中,比如用量子点标记一个靶分子时,可以把一个单一识别部分移接到量子点上(比如DNA的核苷酸和适体,抗体等),或者更简单,把它作为增溶配体。量子点配体带有一个氨基或羧基,这提供了与带有巯基等基团的分子进行交联的可能性,分子交联可以通过标准的生物复合反应完成。另一种利用量子点与带电适体分子之间(或量子点与蛋白质间)静电作用的手段也可以做到。这些起作用的步骤可同样用于增加或改变功能性。比如链霉亲和素包裹的量子点可以用来与生物素化的蛋白质以及抗体结合,甚至使用一般的三层处理方法可以让量子点材料标记绝大多数目标。
很多蛋白的表面接触基团(10到100种)可以把一些功能“移植”到独立的量子点上,使其成为很优秀的探测器。例如,增加识别部分可以让量子点具有穿过细胞膜(或细胞内化)的能力与酶催化功能。通过生物方法合成的,由多肽包裹CdS核构成的量子点材料的诞生引领我们去探究通过包裹多肽来对量子点材料进行表面改良的方法。多肽拥有易于定制的优点,只要单体排列选择正确,只要进行一步表面活性修改就能产生很多必要的功能,如1保护核从而让其保持量子点的物理发光能力2让量子点可溶3,提供一个生物相容的表面,这些使得很多功能能够复合。这样处理后的材料颗粒有胶体的特性,有物理发光能力,还拥有生物相容性,这种“多肽工具包”能轻松按照需求提供额外的功能,这些功能可以通过分子技术的革新提高,这类技术现在很好的完成了纳米晶的识别,合成以及自组装。
量子点在细胞生物学中的应用
在过去的几年内,量子点已经在大多数使用荧光的生物技术应用中被测试过了,包括DNA排列技术,免疫荧光化验,以及细胞生物学与动物生物学。量子点早期在免疫荧光化验技术中最成功的应用是1)标记固定的细胞或组织,2)对膜蛋白,微通道,肌动蛋白,核抗体进行染色,3)对原位杂交的染色体及精梳DNA荧光染色。量子点比一般染料更加亮,因为它的复合效应的消失系数的量级比大多染料的大,同时却有可比拟的量子输出与相似的饱和辐射级别。然而量子点最主要的优势在于长的发光时间(几分钟到几小时),这让我们可以得到清晰且对比度高的图像,这种优势很适合于三维光学切片,其中最重要的是在连续z段检测时漂白荧光,以便于重新构建三维结构。量子点发挥作用后的结果将反映在高解析度的三维共焦图像上,图像由波段3的不可预测的磁畴分布得到,其记录了红细胞中细胞膜蛋白运输阴离子的过程,还记录了一簇在胰腺癌细胞细胞膜上过表达的多药P糖蛋白。量子点在免疫荧光检测中最好用的特性是其产生信号需要的材料的量很少。事实上,一些研究报告有样品的闪烁,这种闪烁现象由少量量子点闪烁造成的。这说明即使是单个量子点也能在细胞免疫学研究中被检测到,一个量子点标记一个分子这种极限的使用方法也行得通。此外,各种颜色的量子点不是很难得到,这些量子点全部能被同一波长的光激发,除了简化图像的获得过程,应用这些量子点能在共焦显微术中得到有很多颜色的纳米级分辨率的图像。
活细胞实验为我们带来了额外的难题,这取决于应用需求(对整个细胞标记,标记细胞膜蛋白,标记细胞质或细胞核)。对整个细胞进行标记在细胞追踪与细胞谱系研究中检测病原体或细胞时很有用,标记可以不使用显微注射,电穿孔,甚至不需要细胞吞噬量子点。通过对样品细胞进行量子点包裹使得癌变的人类吞噬细胞的内化过程被观察到。肽的转导域和阳离子通道被发现在胞吞过程中有很重要的作用,这意味着我们可以对细胞用不同的颜色大幅度染色。通过对量子点功能化可以得到更好的特异性和效率。转铁蛋白在哺乳动物胞吞过程中起作用,一种新的方法成功用于标记病菌和酵母细胞,标记革兰氏阳性的细菌需要用凝集素包裹的量子点探测。种种研究表明,量子点相对于一般染料拥有相当大的优势,它能在可忽略的光漂白下被长时间观察。在Jaiswal等人的实验中,盘基网柄菌细胞依据饥饿时间被染成不同颜色,它们可以在几小时内被分别追踪,这让我们知道这种细菌中只有饥饿的个体才参与基团的中心形成。Dubertret的实验中显示,在Xenopus胚胎中,注射后的细胞在几天生长后依旧含有发荧光的量子点。在所有的原核细胞研究中,量子点最终在细胞内囊泡内被发现,通过细胞器定向标记可以判断到底在内体还是在溶酶体中,还可以通过溶酶体/内体定位确定它是否在细胞核周边区域。即时和长期的观察使跟踪这些水泡成为了可能。
某些功能化处理也被发现可以使量子点能标记细胞表面的蛋白质。一些事例,比如链酶亲和素,次级或初级抗体,受体配位基(表皮生长素EGF等),以及包括生物素-亲和素等亲和对。链霉亲和素量子点被用于探测Her2癌标识,这种标识在SK-BR-3人类乳腺癌细胞表面存在,量子点通过包在外层的生物素化的一级抗体与二级抗体与Her2标记作用来进行标记。另一种方法也被应用在标记被培养的脊骨神经元细胞的甘氨酸受体的研究中,当量子点大量溶解扩散在突触与突触外区域内后就能追踪这种受体。链合亲和素量子点的通用性让它很受欢迎,但是它大的体积以及两层抗体会妨碍它在多聚化受体研究中的使用。对量子点本身功能化并在外包裹一层抗体可以把探测层数目削减到两层,这种方法被用于人类母神经细胞瘤的alpha;v整合素的探测。
还有另一种使用包含交练初级抗体的量子点的方法,这种方法在标记暂时被pgp-编码的质粒感染的Hela细胞的Pgp时有两种使用形式,第一种包含了Pgp初级抗体的生物素化,最终这样处理的抗体被附在抗生素包裹的量子点上。第二种方法需要处理转接蛋白,处理方法是将其和抗体的Fc区段捆绑并利用静电作用与带电量子点结合。两种实验均强调了对转染细胞表面进行标记,以及有着蛋白质保险丝的带绿色荧光的pgp的信号的共区域化。
在进一步缩小量子点器件的尺寸的过程中,研究者使用了表面受体的配位基,通过生物素与链酶亲和素的连接或者直接的交连将其与量子点结合,举个例子,EGF标记的量子点被用来研究癌细胞列的受体调节的信号传导。与细胞丝状伪足的erbB1受体结合的EGF量子点被发现参与了一种之前未被检测到的向着细胞体的逆行传输。标记erbB1受体的EGF量子点在囊泡中的胞饮过程也被观察到了,这将会让我们看到有多重运动模式的扩散,直线运动以及囊泡融合过程。
一些蛋白质能用肽来识别,因而用肽来使量子点功能化很受欢迎,使用肽的方法已经被用于人类母神经瘤的研究,其中使用了一小段加工过的与整合素相对的肽链。肽的使用被证实是一种相对普遍的手段,Akerman等人用了三种不同的肽与量子点结合并将其用于标记体内与体外的肺内皮细胞,脑内皮细胞以及人类乳腺癌细胞。在缺少肽序列或识别基团时,靶分子可经过设计处理使之拥有一个可识别的多肽。我们最近通过亲和素的多肽链与GPI(绑定了人的CD14受体)融合来说明这种方法。生物素化的多肽包裹后的量子点材料用于标记工作于HeLa细胞质膜的亲和素受体,这种受体被发现有单分子敏感度,且对其跟踪发现在几分钟后它们被活细胞的膜融合并在细胞液中活动,这种方法让我们能够研究GPI锚定受体与生物膜脂膜的关系。
原则上,同一种量子点可以标记细胞质或细胞核的靶目标,然而,量子点需要进入细胞质并且不能在到达目标的路上被困住。一项最近的研究显示通过微注射能把用靶向肽序列修饰的量子点送到线粒体或者细胞核,然而所有其他研究显示量子点似乎最终都会聚集在内体,这一问题广收关注与研究。第二大困难是,到达细胞器的量子点是不可能被清除掉的,不像其他的膜外标记实验那样有被清洗的可能。
量子点在动物生物学中的应用
量子点长时间的稳定与亮度使其成为了理想的用于动物标记与成像的候选者,用双光子共焦显微术对活鼠的血管进行成像,血管内通过静脉注射已经含有了量子点,结果得到了高对比度与图像深度的影像,而且激发能要比有机染料低。一个类似的着重于活鼠长时间成像的实验表明,用大分子量的PEG分子包裹的量子点能减少其在脏器与骨头中的累积,这有很大的重要性。几个月后,量子点在骨髓与淋巴结中依旧可见,说明了其极好的稳定性。
肽修饰的量子点最初通过静脉注射来标记组织特异的血管标识(肺血管和癌细胞),经过五到二十分钟循环的不同器官的组织切片显示肽修饰的量子点到达了它们的目标地,且其被目标细胞的囊泡内化而非存在于周围组织,这可能是因为量子点有相对于染料分子有更大的尺寸(传统染料会污染周围组织)。用靶向量子点对活动物成像最近在小鼠身上被成功应用,这一工作由Gao等人完成,他把用抗体修饰的PEG包裹的量子点通过静脉注射标记了前列腺特异的膜抗原。由于量子点能发出可见光谱,光谱的分裂演算被用于分离转移的瘤的组织自发荧光与量子点信号。自发荧光干扰观测的难题被Kim等人解决了,他通过静脉注射把辐射NIR(850nm)的量子点注射到猪和鼠的体内,量子点很快到达了淋巴结并且可以在无背景时被观察的很清楚,之后他们利用图像来指引了猪的淋巴结切除术,这表明量子点的IR成像可能可以对人类的外科手术提供帮助。
细胞毒性
量子点在标记细胞时直接和间接的细胞毒性无论是在活细胞还是动物实验中都是头等大事,这些问题因为我们已经提出的综合因素,如溶解度,以及复杂的实验报告等原因而变得很复杂。大部分报告显示没有发现在标记有效的浓度下经过持续的实验(几小时到几天)后量子点对细胞的存活,形态,功能以及生长有负面的影响,然而在高浓度下,量子点对胚胎的发育的不良影响变得可以被注意到了。对核的保护的核/壳材料越少,对细胞生存与功能产生影响的信号出现的越快。因为核/壳材料会释放Cd2 或者Se2-。量子点并不是完全没有毒性,但是在研究过程中存在一个安全范围能在完成任务的同时不产生大的影响。自然地,我们需要让量子点完全无毒,这样量子点才能被应用于医药过程。
展望
现在量子点技术的图景必定会很快具有很多层次的应用。综合上,新的结构组成能让量子点具有新的性能,如1)对电磁场敏感2)发出更窄得荧光并具有更长的使用时间(如用镧系掺杂量子点) 3)更小的尺寸与NIR光谱的延伸,比如使用三元合金强化4目的特定的纳米棒量子点5闪烁的抑制及纳米输出的增强6内置的开关或光电生物传感器,这个开关特指一种麦芽糖感应器,可以通过把量子点与一种荧光熄灭分子相结合得到,这种分子在与靶作用时或是在某种化学物质或是酶的存在下可以被分离或劈开。这将在胞内应用有很大的前景,在细胞内无法除掉
全文共7581字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[115],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 复杂热电材料外文翻译资料
- 以自蔓延高温烧结方法制备热电化合物以及燃烧合成的新标准外文翻译资料
- 氮掺杂分级多孔碳作为氧还原反应的高效电化学催化剂的研究外文翻译资料
- 孪晶诱导塑性高嫡合金的设计外文翻译资料
- 含铌先进Fe-Cr-Ni型奥氏体耐热钢富铜相的析出强化在超临界电厂的应用外文翻译资料
- 不同温度下直接能量沉积层状工具钢的弯曲强度外文翻译资料
- BiFeO3的光伏效应外文翻译资料
- 通过氢稳定的MgaPt研究核壳纳米结构Mg@Pt中快速“氢泵”的可视化外文翻译资料
- 一种铱核心环金属有机配体显著地提高了有机太阳能电池 的光伏性能外文翻译资料
- 钠离子电池的高性能阳极材料:三组分共组装法制备层次多孔碳外文翻译资料


