
英语原文共 15 页,剩余内容已隐藏,支付完成后下载完整资料
.
肿瘤治疗用协同药物组合的纳米医学
策略与展望
摘要
纳米药物的协同药物组合在癌症治疗中显示出越来越重要的意义而且在临床实践中为目前的药物联合治疗提供优越的治疗益处。在本文中,我们将探讨应用纳米载体改进的@原理和优点。抗癌药物联合治疗,回顾使用纳米载体递送多种组合不同种类抗癌药物,(包括小分子药物和生物制品)@并讨论挑战以及基于纳米载体的联合疗法的未来前景。这篇评论的目的是提供更好的对癌症治疗这个新的重要范式的理解和理性的关键考虑肿瘤治疗协同药物组合纳米药物的设计 。
1。介绍
全球估计有超过1410万例新的癌症病例。发生在2012甚至排除非黑色素瘤皮肤癌〔1〕。尽管几十年来抗击癌症的巨大努力近年来新的治疗药物和治疗方法的研究进展仍然是导致疾病相关死亡的第二大原因美国[ 2 ],并上升到第一个主要死亡原因加拿大[ 3 ]。癌症治疗的令人失望的临床结果很大程度上归因于这种异质性和复杂性毁灭性的疾病传统上,手术和放射治疗都是用于局部疾病的治疗,而激素治疗、化疗、免疫治疗和靶向治疗仅用于全身治疗或与其他方式相结合〔4—7〕。化疗是治疗原发性和转移性癌症的标准治疗方法,但其临床益处有限,特别是单药治疗时,单细胞治疗的共同问题包括细胞和肿瘤水平的耐药性,HA。RSH肿瘤微环境,阻碍药物渗透和疗效,肿瘤异质性和剂量限制性毒性(补充材料-表S1)。因此,包含两种或两种以上经典抗癌药物的联合化疗方案已在临床实践中应用数十年来治疗各种癌症(补充)材料. 表S2)[5,8 - 11 ]。然而,结果仍然是不令人满意的随着对肿瘤生物学、分子途径、肿瘤微环境和肿瘤-宿主相互作用的认识的加深,新的联合治疗方法得到了发展。新的联合疗法包括免疫治疗化疗、靶向治疗化疗、基因化疗(即DNA和RNA基)治疗或表观遗传治疗、免疫治疗和靶向治疗(12—20)。
临床证明,单次治疗有效,无需额外毒性,可获得较好的治疗效果。然而,联合治疗的临床结果并不总是像预期的那样好,而是常常与较高的毒性相关,尽管非重叠毒性是选择药物的主要考虑因素。组合候选人[ 21 - 23 ]。除了不必要的毒性升级之外,联合药物治疗的成功也受到阻由于无法实现组分药物实现所需的时空
当它们以游离分子形式(24—26)递送时,关键的是药物组分在合适的时间被输送到正确的位置;然而药物成分之间的物理化学和药代动力学性质的内在差异。
为了@防止这种情况发生,必须@有一个有效的药物载体。
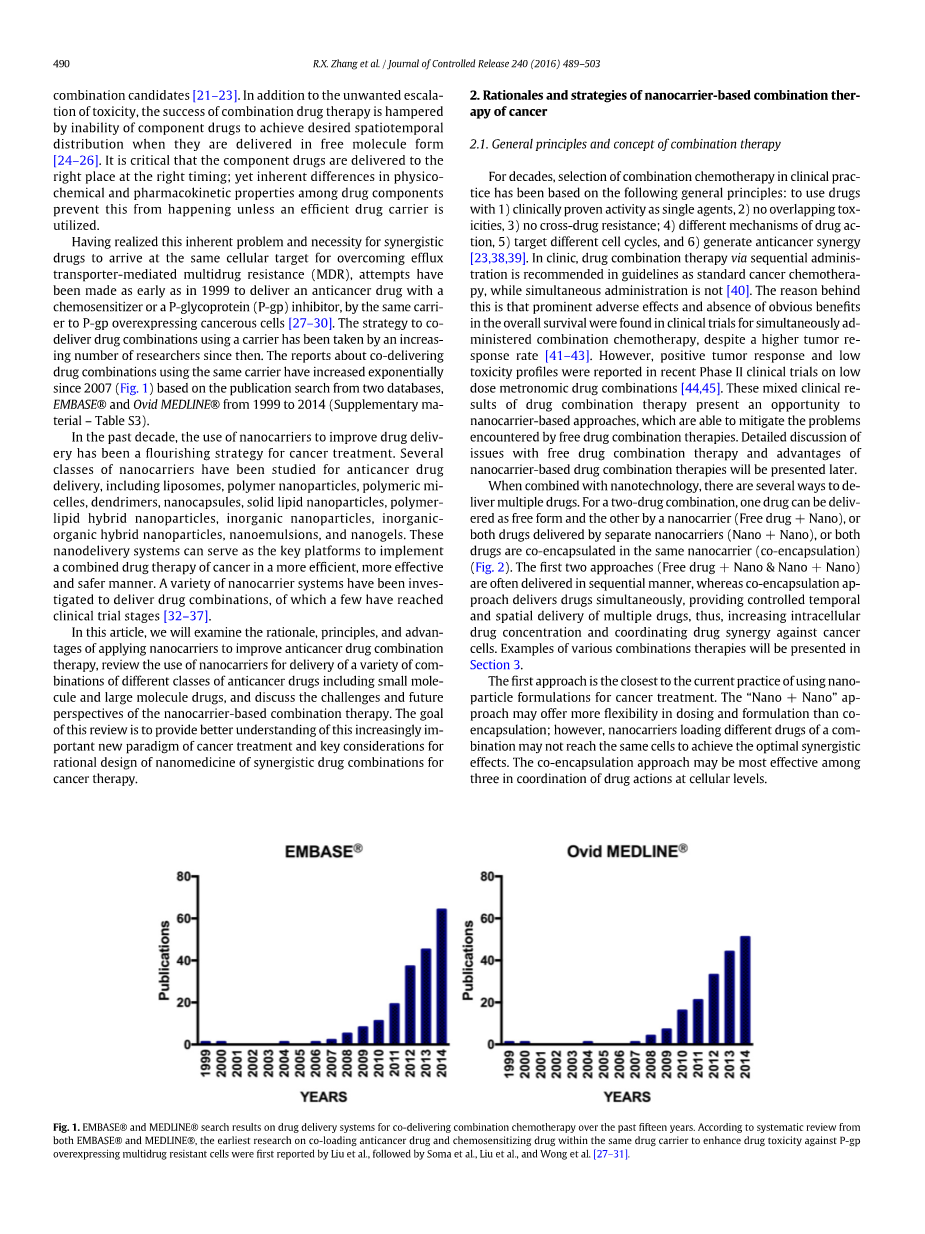
这一固有的问题和必要性的协同药物达到相同的细胞目标用@以克服外排转运蛋白介导的多药耐药性(MDR),早在1999已经尝试用抗癌药物或P-甘氨酸递送抗癌药物。COP(P-gp)抑制剂,由同一载体向P-gp过度表达癌细胞[27 - 30 ]。从那时起,越来越多的研究者采取了使用载体联合药物组合的策略。关于使用同一载体共同递送药物组合的报告自2007(图1)根据两个数据库的出版物搜索而成倍增加,
在过去的十年中,使用纳米载体来改善药物的输送已经成为癌症治疗的一个普遍被使用@的策略。研究者@已经研究了几类纳米载体用于抗癌药物递送,包括脂质体、聚合物纳米颗粒、聚合物胶束、树枝状聚合物、纳米胶囊、固体脂质纳米粒、聚合物脂质杂化纳米粒子、无机纳米粒子、无机有机杂化纳米粒子、纳米材料。混合和纳米凝胶。这些纳米递送系统可以作为以更有效、更有效和更安全的方式实施癌症联合药物治疗的关键平台。已经研究了多种纳米载体系统来递送药物组合,其中一些已经达到@临床试验阶段〔32—37〕
2。纳米载体联合治疗癌症的原理与策略
2.1。联合治疗的一般原则和概念
几十年来,联合化疗在临床实践中的选择是基于以下几个原则:
1)临床证明作为单一药物的活性;
2)无重叠毒性,
3)无交叉耐药性;
4)不同的药物作用机制,
5)靶向不同的细胞周期,6)产生抗癌协同作用。
[23,38,39 ]。在临床上,在标准化癌症化疗指南中推荐通过序贯给药的药物联合治疗,而同时给药不是(40)。这背后的原因是,在同时给予联合化疗的临床试验中发现显著的不利影响和明显的益处在总体生存中的缺失,尽管肿瘤响应率较高(41—43)。然而,肿瘤的阳性反应和低
在低剂量节拍器药物组合的最近II期临床试验中报道了毒性谱[44,4]。这些混合的临床结果的药物联合治疗提供了机会纳米载体为基础的方法,这能够减轻所遇到的问题,免费药物组合疗法。详细讨论自由药物联合治疗的问题和基于纳米载体的药物联合治疗的优势,稍后将介绍。当与纳米技术结合时,有多种方法可以递送多种药物。对于两种药物组合,一种药物可以以游离形式递送,另一种药物可以通过纳米载体(游离药物 纳米),或由单独的纳米载体(纳米 纳米)递送的两种药物,或两种药物共同封装在相同的纳米载体(共封装)中(图2)。前两种方法(免费药物 纳米和纳米 纳米)经常以顺序的方式递送,而共胶囊化方法同时递送药物,提供多种药物的@在可控时间和空间内@递送,从而增加细胞内药物浓度和协调。抗癌药物的协同作用。各种组合疗法的例子将在第3节中介绍。第一种方法是最接近目前使用纳米制剂治疗癌症的做法。“纳米 纳米”的方法可以提供更多的灵活性,在剂量和配方比共胶囊化,但是,纳米载体装载不同的药物组合可能无法达到相同的细胞,以达到最佳的协同效应。在细胞水平的药物作用协调中,共封装方法可能是最有效的方法@,组合候选人[ 21 - 23 ]。除了不必要的毒性升级之外,联合药物治疗的成功受阻于当药物以游离分子形式(24–26)递送时,无法实现组分药物实现所需的时空分布。重要的是,虽然@在适当的时间将成分药物输送到正确的位置@但是药物成分之间的物理化学和药代动力学性质的内在差异。@有效的药物载体是这样的实现了这一固有的问题和必要性的协同药物达到相同的细胞目标,以克服外排转运蛋白介导的多药耐药性(MDR),早在1999已经尝试用抗癌药物或P-甘氨酸递送抗癌药物。COP(P-gp)抑制剂,由同一载体向P-gp过度表达癌细胞[27 - 30 ]。从那时起,越来越多的研究者采取了使用载体联合药物组合的策略。关于使用同一载体共同递送药物组合的报告自2007(图1)根据两个数据库的出版物搜索而呈指数增长,
EPASEreg;和奥维德MEDLINEreg;从1999到2014(补充材料)
2.2。合理用药组合与治疗方案的选择
除了上述基本原则之外,在药物组合候选者的选择中还必须考虑其他因素,包括药物-药物相互作用引起的代谢改变、处置和消除、最佳药物与药物的比率和给药安排。虽然联合用药的最终目标是达到最大的治疗效果和最小的毒性,但联合治疗的抗癌作用可能并不总是协同作用的,但它可以是添加剂,甚至是拮抗剂,这取决于药物的设计和治疗方法。APY实现。已经发现,药物与药物的比例和给药时间表是决定药物相互作用是否会产生协同效应的关键因素[38,44-51,54,56,57 ]。如果需要在同一细胞上发生药物作用,可以在设计合适的递送系统之前在体外确定最佳药物比和计划。药物相互作用的效果通常通过使用广泛应用的中效分析[39,52,54,58],使得计算组合指数(CI)以确定效果是否为添加剂(CI=1)、协同效应(CI B 1)或拮抗剂(CI N 1)〔58〕。加性相互作用意味着所有药物的组合效应等于药物单独作用的总和,而协同相互作用和拮抗作用意味着组合效应大于或小于个体效应的总和。一个“好”的组合将导致添加剂或协同治疗效果,这通常是通过结合药物与非重叠的作用机制和毒性谱设计的[58 ]。当药物适当组合时,它们可以延迟或克服MDR并防止患者治疗机智。H标准治疗从复发[39,58- 60 ]。确保最佳的药物与药物的比例,以交付到肿瘤是至关重要的,以实现提高疗效。Mayer和同事报告了脂质体中5:1协同增效比的伊立替康和氟尿嘧啶的联合递送增加了大肠肿瘤异种移植物的抗癌活性,而当拮抗药物组合比率被递送时,观察到减弱的抗癌活性。肿瘤[50 ]。哈森斯汀等。还证明,以胶束为载体,以紫杉醇、雷帕霉素和17-AAG的协同药物组合以2:1∶3M比率共同递送,对于提高体内的治疗效果是非常重要的〔34〕。给药组合的时机对于发生协同效应也是重要的[ 57 ]。Cheung等人。发现DOX和MMC以1.7:1的固定比,协同抗肿瘤作用EMT6乳腺癌细胞是最强的,当DOX和MMC是目前应用或当DOX之前给予MMC治疗,但不是当MMC作为预处理应用[ 57 ]。药物相互作用机理的进一步研究表明,MMC生物还原代谢产生的甲醛可通过结合解毒酶谷胱甘肽(GSH)促进细胞内的DOX积累。与DNA的生物活化MMC交联,DNA修复酶可以在很大程度上激活,以使拓扑异构酶IIalpha;与细胞核中的DOX发生碰撞的机会充分,导致更多的DNA双链断裂和更高的细胞死亡[39 ]
2.3。免费药物组合的常见问题
联合药物治疗的一个关键问题是“以何种方式”。治疗的多个成分应给予达到最佳效果。如表1所概述的,一些障碍可能会损害联合治疗在游离药物溶液中的效果,导致不良的对抗性结果。值得注意的是,这些问题在临床癌症治疗中常遇到。例如,许多化疗药物和新靶向药物的水溶性差,不能有效地输送到肿瘤部位[64 ]。当一种组分药物具有渗透性或稳定性问题时,类似的情况就容易@发生例如在组合治疗中包含小干扰RNA(siRNA)[65 ]。在许多情况下,组分药物具有不同的肿瘤处置和药代动力学特征。因此,不是所有的A组分药物联合可以达到肿瘤组织和细胞的理想状态。比率和持续时间,导致次优的功效和增加治疗的非特异性毒性。
2.4。纳米载体联合治疗癌症的优势与策略
纳米载体系统具有许多优点,如药物包封和难溶性药物的增溶、药物保护、通过胞吞作用的纳米颗粒的细胞摄取、通过增强的渗透性和保留(EPR)效应、靶向递送和受控/ S的被动肿瘤积累。释放动力学。通过利用这些优点,可以有效地递送多个抗癌药物并在药剂何时和何时分布在体内[66,67 ]进行操作。此外,纳米载体还有许多其他优点,如可溶性和难溶性药物的共载,小分子药物和高分子药物的共同作用,以及刺激反应性药物释放。纳米载体系统的这些优点对于解决上述组合问题都是有价值的。癌症治疗与免费药物配方。通过适当整合纳米技术联合治疗,可以实现几个积极的成果。鉴于几种药物共封装的特殊挑战,例如,比率计量配药,在接下来的内容中,我们将主要讨论使用纳米载体系统的优点和策略。
如上所述,两种药物对癌症的固定比率某些药物组合需要细胞来产生协同抗癌作用;然而@如果给药组合的自由溶液,这是非常难以实现的。由于不同的药代动力学、组织配置和组分药物的细胞摄取,最初的药物与药物的比率在短时间内不再维持在循环和肿瘤组织中(图4A,左面板)。此外,由于共同代谢和排泄途径导致的药物相互作用可能导致更高的组织毒性和改变的药物比例,以及药物的低积累。相反,当这些药物在OnNeNa携带者中共封装并以相似的速率释放时,它们的协同比(例如)。药物A对药物B的2:1可在血液和肿瘤中高浓度维持很长一段时间(图4A,右面板)[38,50,51,555 ]。通过EPR效应或受体介导的外渗,在肿瘤组织中积累的纳米载体,随后通过被动或受体介导的内吞作用摄取细胞(图4B),可以同步生物分布、肿瘤积累和局部药物有效性。纳米载体可以释放癌细胞内的药物,在这种情况下产生协同效应。SunHunder-et等人证明的链断裂。使用DOX和MCM-CO加载PLN(图4B)[39,56]。因此,治疗效果显著增强,靶向毒性显著降低[32,33,38,53- 55 ]。在纳米颗粒内共包封药物也可用于递送两种或多种药物,它们作用于不同的靶点,但需要在亚细胞水平上协同递送。在多药耐药肿瘤细胞中增强药物积累的一种常用策略是使用P-gp抑制剂。WO等,表明共加载DOX(P-gp底物)和PLN中的Elacridar(GG918)(P-GP抑制剂)优于单独的PLN与MDR人乳腺癌中的DOX和GG918的联合施用,表明GG918与纳米颗粒的DOX共定位对于提高DOX细胞摄取、保留和由此更高的细胞毒性是重要的。尼斯[ 30 ]。三聚氰胺(胶束与三重药物:紫杉醇、雷帕霉素和17-AAG)是在一个纳米载体内共封装的另一个例子,通过靶向多个细胞靶来实现与多个癌细胞系的协同作用〔34—36〕。紫杉醇是一种有丝分裂抑制剂,其细胞毒性可能进一步增强。
三。纳米载体联合治疗癌症的实例
因为小分子药物(即细胞毒性抗癌药物)和大分子药物(即生物制品,包括蛋白质、DNA和RNA)在它们的递送中往往会遇到明显不同的问题集,我们在以下各节分别进行了综述。此外,我们在表中仅列出了已经在体外和临床前研究或临床试验中研究的纳米颗粒共同递送的药物组合的代表性实例。有很多例子在体外研究,只是由于空间限制而没有列出。
3.1。基于纳米载体的小分子药物组合
小分子抗癌治疗通常包括化疗,有时激素治疗时,癌症是激素依赖性的(例如乳腺癌)。结合多个小分子可以增加抗癌效果,因此经常用于临床设置。纳米载体联合疗法的研究进展癌症也有类似的趋势。该组合通常包括具有非重叠细胞毒性机制的抗癌药物,如第2.4节所述的纳米载体的附加优点。
表2给出了使用体外和体内研究的纳米颗粒(32—36、38、39、49~56、69- 80)的抗癌药物组合的联合递送的选择性实例。在列表的顶部是脂质体制剂与伊立替康和氟尿苷在1:1M比(CPX-1)或阿糖胞苷和柔红霉素在5:1 M比(CPX-351)由CELTERreg;药物开发。CXX-1已进入治疗晚期结直肠癌的第二阶段试验[69 ]和CPX-351(VYXEOS),用于难治性急性髓系白血病的III期临床试验[33,81,82]。在各种临床前白血病肿瘤模型中,可注射的脂质体制剂CPX-351保持不变。
阿糖胞苷与柔红霉素联合用药的增效比在血液循环期间,与等效剂量比的游离药物组合相比,显著提高了治疗效果和低毒性(图5)〔38〕。在最近完成的第二期急性白血病第二期随机试验中,CPX351(VYXEOSmu;)显著改善了患者的总体生存率,甚至提高
全文共43316字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[17382],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 选择性能量转移催化烯烃的含硼几何异构化外文翻译资料
- 瑞德西韦阻滞SARS-CoV-2聚合酶的作用机理外文翻译资料
- 铱催化的共轭二烯的C-H烯基的烯丙基化反应外文翻译资料
- 铱和布朗斯特酸协同催化烯丙醇对萘酚衍生物的对映选择性脱芳构化外文翻译资料
- 新型选择性MT2受体配体2-(苯硫基)苯并[b]噻吩类化合物的制备和药理学评价外文翻译资料
- Ilimaquinone是一种海绵代谢产物,通过gadd153介导的途径发挥抗癌作用外文翻译资料
- 用环境敏感药物释放的三氧化二砷靶向介孔二氧 化硅纳米颗粒有效治疗三阴性乳腺癌外文翻译资料
- 复方中草药对雄性荷斯坦犊牛生长表现,胴体特征和肉质的 影响外文翻译资料
- 线粒体在没有人体ATP合酶的亚基c时渗透性转 变的持久性外文翻译资料
- 基于呋喃类化合物构建环氧树脂 2,5-呋喃羧酸(FDCA)生物基环氧树脂的合成及性能研究外文翻译资料


