
英语原文共 4 页,剩余内容已隐藏,支付完成后下载完整资料
介孔氮掺杂碳电催化合成过氧化氢
Tim-PatrickFellinger,Fred́eŕicHasche,PeterStrasser,andMarkusAntonietti
DepartmentofColloids,MaxPlanckInstituteofColloidsandInterfaces,WissenschaftsparkGolm,D-14424Potsdam,Germany
DepartmentofChemistry,TechnischeUniversitaẗBerlin,Straszlig;edes17Juni124,D-10623Berlin,Germany
摘要
源自离子液体N-丁基-3-甲基吡啶二氰胺的中孔氮掺杂碳是用于电化学合成氢的高活性、廉价、有选择性的非金属催化剂。过氧化物具有潜在的安全性,可持续性和廉价的基于流量反应器的生产水的方法。
正文
过氧化氢是世界上100种最重要的化学物质之一[1]。最简洁,最有效的反应途径是元素氢和氧的直接转化[2]。但是,使用过程存在爆炸的危险。电化学流动反应器,例如聚合物电解质膜燃料电池(PEMFC),是一种通过在能量共生时分离氧还原和氢氧化的有效选择[3,4]。因此,双氧水的电化学合成法在不断的研究中[5-12],但电催化剂仍存在成本高、选择性差、活性低等问题。在此,我们证明了离子液体衍生的介孔氮掺杂碳是一种高效、廉价、选择性的无金属催化剂,可以电化学合成过氧化氢,并有可能建立一种安全、可持续、廉价的以流反应器为基础的生产方法。
随着新型介孔无金属催化剂的合成,氢燃料电池中的氧还原反应(ORR)在基本介质中的活性可与商业铂催化剂相媲美,我们和其他人最近可能会认可高ORR活性氮掺杂碳的论文[13,14]。然而,我们的氮掺杂碳催化剂在聚合物电解质膜燃料电池(PEMFCs)酸性介质中也具有相当高的催化活性[13]。
对电化学过程的力学分析表明,转移电子的数量并不总是4个,这与理论上氧气完全还原为水的情况不同;在某些情况下,会计算较低的、不均匀的值。这些混合过程表明不同的碳氮结构(如吡啶基、吡咯基或四元基)具有不同的反应活性。这也为在含氮导电碳的基础上,从氧到氢的纯二电子反应找到一种选择性的高效电催化剂提供了希望。根据一种已经在别处详细描述过的主要方法[15-17],离子液体正丁基-3-甲基吡啶双氰胺(BMP-dca)被用作氮掺杂碳(BMP-800)的直接前体。利用商业二氧化硅纳米颗粒(LudoxHS40)进行一种简单的硬模板(纳米铸造)工艺,得到了介孔(孔径2-50nm)氮掺杂碳(meso-BMP-800)催化剂。
高分辨率透射电子显微镜(HRTEM)显示了BMP-800的低长程有序特征结构(图1A)。类石墨薄片弯曲的原因是大量的结构整合氮(16.2 wt%)。尽管表面上看是无序的结构,但掺杂导致了高导电性和稳定性,因此对电催化性能的要求很高[15]。meso-BMP-800中孔的成功引入最初是通过TEM成像实现的,展示了混合二氧化硅/离子液体材料碳化后复制的无机纳米颗粒的结构,随后去除模板(图1B)。
图1:(A)BMP-800和(B)meso-BMP-800的TEM显微照片。
在meso-BMP-800上进行的氮吸附测量确定了约320m2gminus;1的高比表面积,同时这也是催化活性表面。在较高的相对压力(p/p0gt;0.7)下观察到具有迟滞的Ⅳ型等温线,这表明了中孔材料(支持信息中的图1)。通过对狭缝和圆柱状孔隙的非局部密度函数理论(NLDFT)模型进行孔隙分析,发现平均孔径为13.2nm,与TEM图像测得的孔径和所报道的商用二氧化硅颗粒的直径为13.2nm相对应[18]。广角x射线散射(蜡)(图2)表明特征层间(002)和层间(002)衍射峰2Theta;=26.14°,42.98°,分别证实了硅模板的去除。与石墨(335.4pm)相比,340.6pm的平均层间距离较长,高分辨率透射电子显微镜观察到的弯碳结构的结果也是如此。通过x射线光电子能谱(XPS)和元素分析(EA)测定,氮含量为14.2 wt%(XPS)/17.17 wt%(EA)。这些值的变化可以用XPS测量的表面特异性来解释。在其灵敏度范围内,XPS同时测定了催化剂的非金属性质(Fe含量0%,无其他金属指示;图3s)。
采用旋转圆盘电极(RDE)技术对中观bmp-800催化剂的阴极半电池性能进行了电化学测试。以纯水、2-丙醇和Nafion为粘结剂,制备了催化剂悬浮液。悬浮液的一部分沉积在光滑的玻碳电极上并干燥,用0.1M HClO4进行RDE实验。酸性条件模拟燃料电池条件,质子由阳极氢氧化反应通过扩散聚合物电解质膜提供。记录了除氧0.1M HClO4在不同转速下的极化曲线(代表不同的供氧量)和循环伏安图(CV)。meso-BMP-800的CV剖面(图2插图)显示了一个接近矩形的形状,表明碳的高导电性和相对于商用碳的电容电流增加。
图2:与卡博特导电碳黑Vulcan XC 72R相比,meso-BMP-800催化剂的电化学表征:在氧饱和0.1M HClO4中不同旋转速率下的极化曲线和在去氧0.1M HClO4中不旋转时的循环伏安图。
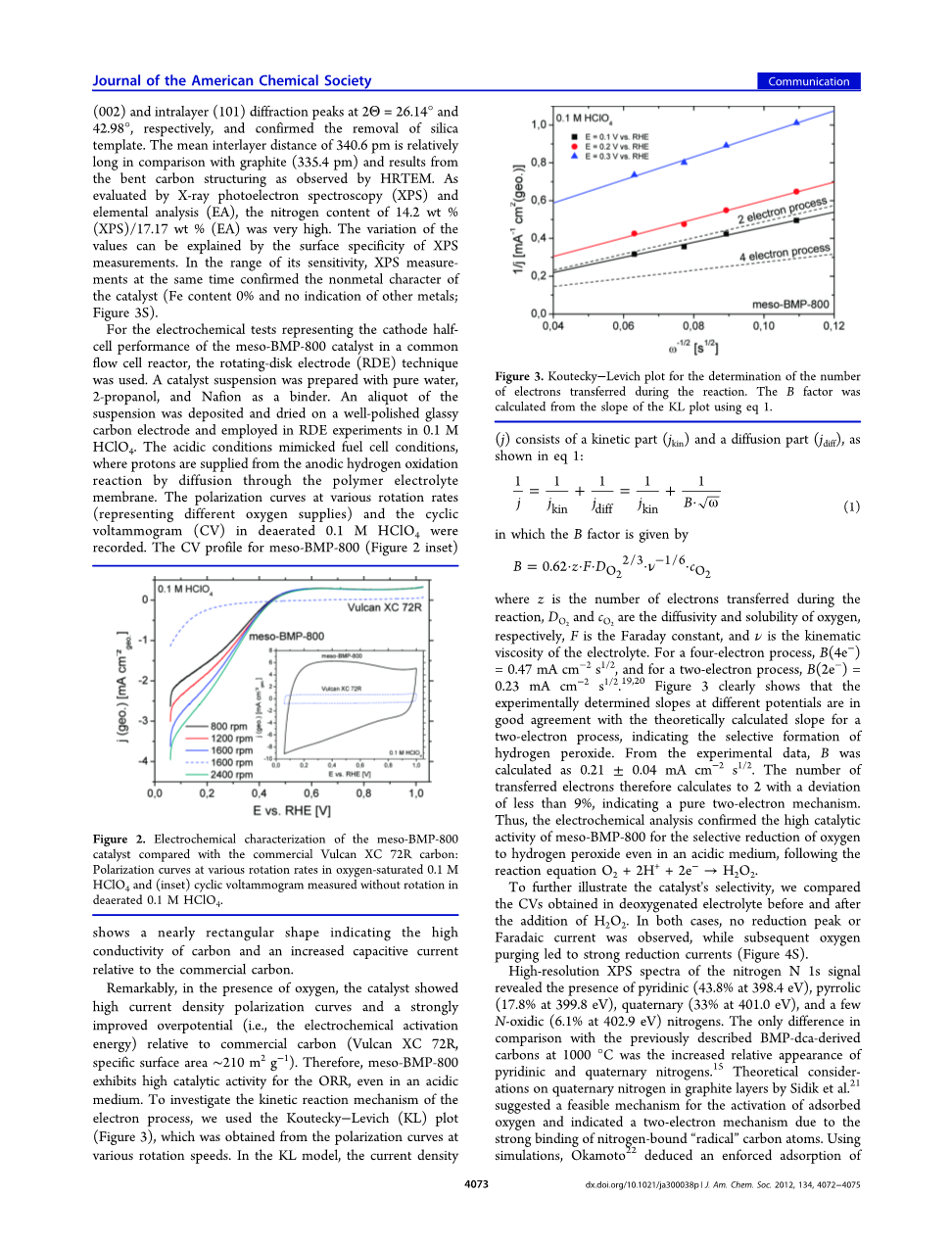
值得注意的是,在氧气存在下,催化剂呈现出高的电流密度极化曲线和明显改善的过电位。与商品碳(Vulcan XC 72R,比表面积为210 m2gminus;1)的电化学活化能。因此,即使在酸性介质中,meso-BMP-800对ORR也表现出较高的催化活性。为了研究电子过程的动力学反应机制,我们使用了Kouteckyminus;Levich (KL)图(图3),这是从不同转速下的极化曲线得到的。在KL模型中,电流密度(j)由动能部分(jkin)和扩散部分(jdiff)组成,如公式1所示:
(1)
其中B为
式中,z是电子转移反应,和分别是氧气和二氧化碳的扩散系数和溶解度,F是法拉第常数,nu;是电解质的运动粘度。四电子过程中,B(4eminus;)=0.47mA cmminus;2s1/2,双电子过程中,B(2eminus;)=0.23 mA cmminus;2s1/2[19-20]。图3清楚地表明,在双电子过程中,实验测定的不同电位处的斜率与理论计算的斜率一致,表明过氧化氢的选择性形成。根据实验数据,B的计算值为0.21plusmn;0.04 mA cmminus;2s1/2。因此,转移的电子数计算为2,偏差小于9%,表明是纯双电子机制。因此,电化学分析证实了meso-BMP-800即使在酸性介质中也能选择性地将氧还原为过氧化氢,其反应方程式为O2 2H 2eminus;→H2O2。
图3:用于测定反应中转移的电子数的Koutecky-Levich图。B因子由KL图斜率(eq1)计算得到。
为了进一步说明催化剂的选择性,我们比较了添加H2O2前后在脱氧电解液中得到的CVs。在这两种情况下,都没有观察到还原峰或法拉第电流,而随后的氧净化导致了强还原电流(图4)。
氮N1s信号的高分辨率XPS光谱显示,存在吡啶(398.4eV时为43.8%)、吡咯(399.8eV时为17.8%)、四元(401.0eV时为33%)和少量N-肟(402.9eV时为6.1%)氮。与前面描述的bmp-dca衍生碳在1000℃下的唯一区别是吡啶和季氮的相对外观增加[15]。Sidik等人[21]对石墨层中第四系氮的理论研究,提出了一种激活吸附氧的可行机制,并指出氮结合的“自由基”碳原子的强结合是一种双电子机制。通过模拟,Okamoto[22]推断,随着相邻的氮原子数目的增加,氧分子在碳碳双键上的吸附作用增强。他们实际上可以解释系统内部的两个和四个电子的过程。
此外,还对电化学生成和积累H2O2进行了测试和验证,以便更直观地演示如何使用光度法的方法。为此,我们使用简单的三电极催化剂实验装置,在酸性介质和一种催化剂加载约325mu;g cmgeominus;2。电解液(0.1 M HClO4)用O2连续充气冲洗(226 mL minminus;1),工作电压恒定于E=0.1V vs RHE(在高产率范围内;结果电流为-0.01A mgcat-1。样品经过一定的时间后,中和,按照商业过氧化测试的要求进行颜色反应,然后用光度法测量(图4),使用比尔朗伯定律来评估有效的过氧化浓度。
图4:光度法测定H2O2(通过Merck过氧化试验)作为时间的函数。图中显示了电化学产生H2O2的电流(蓝色●)和浓度(黑色■)随时间的变化。
当前和过氧化氢形成保持稳定不变的工作电压超过5.5h。理论所需特定电能产生1g过氧化氢的,根据公式的分母eq2使用z=2和过氧化氢的摩尔质量(M)。使用平均电流I(0.63mA)、反应时间t(5.74h)、工作电压E(0.1V对RHE)和由浓度cm和电解质体积V计算得到的H2O2质量(1.5mg),根据公式2的分子,实际(实际)比能为0.241Whg。因此,感应电流的效率εF(eq2)是65.15%,这可以通过在酸性介质中过氧化物的同时歧化来解释。
就灵活性而言,在廉价的非金属电催化剂如燃料电池型流动反应器等适当的生产装置中的使用尤其具有吸引力(但不仅限于此)。可以在需要的地方(例如在洗涤中)和正确的时间点直接合成少量过氧化氢。此外,这种方法非常便宜(以每千瓦时10欧分的行业价格计算,生产每千克H2O2需要电费2.4欧分),而运输液体危险物质H2O2的成本可以避免。因此,将催化活性精确地归属于一个特定的结合位点似乎是一种推测。除了增加氮含量保持足够的电导率的重要性(见参考文献22),另一个可能影响反应活性的因素是石墨化的程度。这里,石墨层的极化率应该影响吸附性能,而共轭pi;系统的伸长率可以确定关键的电子性质。激进的氮结合的碳原子数可能支持双电子的过程,共轭较少的pi;系统应该更有利于合成过氧化氢[21]。然而,掺氮碳材料作为金属及合金催化剂的支撑材料,在甲醇氧化反应或氧还原成水等方面也受到了广泛的关注[23,24]。
综上所述,我们证明了导电氮掺杂碳是一种高效、无金属的催化剂,可用于选择性、绿色、廉价的电化学生产过氧化氢。除了简单和便宜之外,催化剂的合成还足够灵活,可以进一步优化孔隙率和表面积。
到目前为止,结构对反应活性的真正依赖关系还不清楚,需要进一步的研究。然而,由于在更高温度(1000℃)下合成的类似材料支持四电子制程,因此可以做如下假设:(1)与冈本的模拟[22]一致,氮含量的增加可能有利于二电子制程。(2)氮结合碳的“自由基”特征是双电子过程所必需的[21],meso-bmp-800的“自由基”特征可能更为明显,因为其离域程度较低。(3)高分辨率XPS所阐明的碳材料中的吡咯氮位点,在较高的合成温度下并不存在,可能确实对双电子过程的活性起着重要作用。
在未来,我们希望通过合作来回答这个问题,包括更详细的原子特征描述。进一步的工作还将涉及分析这类可持续的催化剂对其他基本电化学反应的更广泛的适用性。
方法BMP-dca购自离子液体技术有限公司。40 wt %的水分散体的硅溶胶HS40,全氟磺酸117解决方案(5 wt %),和NH高频是来自奥尔德里奇,0.1 KOH溶液和过氧化检测包从默克公司购买。所有的化学药品在没有进一步净化的情况下被使用。将BMP-dca(2g)与40wt%Ludox分散体(5g)混合,并将混合物转移到氧化铝坩埚中碳化。在vmk80 S实验室炉(德国利恒热工有限公司)的氮气流下进行热处理。清洗半小时后,将样品以10k minminus;1的升温速率加热至800℃,并在800℃恒温1小时。研磨得到的黑色固体,然后用4M NH4HF2溶液去除二氧化硅。用水清洗,然后晾干,得到一种细的黑色粉末。电化学表征是使用RDE(美国PINE Instruments公司)技术在一个定制的带有商用恒电位器的三室电化学玻璃电池(VSP-5,BioLogic,法国)中进行的[15]。该三电极装置包括一个铂网对电极、一个可逆氢电极(Hydroflex HREF,Gaskatel,德国)参比电极和一个直径5 mm(0.196cm2)的商用固定玻碳工作电极(PINE Instruments,USA)。准备工作电极催化薄膜,将约15毫克的催化剂悬浮在1.99毫升的纯水、0.5毫升的丙胺和10mu;L 5wt%电解质溶液的混合液中。超声处理后,将10mu;L催化剂的悬浮液置于抛光良好的玻璃碳电极上,并在60°
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[254531],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 茶叶废渣中的活性炭材料与其在溶液中去除靛蓝和胭脂红 的能力:合成、批量处理以及优化研究外文翻译资料
- 有机磷化合物作为碳钢在循环冷却水中腐蚀的抑 制剂:失重法、热力学和量子化学研究外文翻译资料
- 新型绿色多组分中央空调冷却水缓蚀阻垢剂外文翻译资料
- 骨组织工程用可生物降解含银多孔镁基支架的合成与体外表征外文翻译资料
- 铜集流器对Mg- s电池电化学机理的影响外文翻译资料
- 立陶宛五种耕作制度下农田土壤CO2排放的试验分析外文翻译资料
- 新型芳香族氨基亚甲基膦酸酯作为油田阻垢剂的研究外文翻译资料
- 混合电镀废水的回收工艺外文翻译资料
- 黄麻纤维生物吸附剂对苯胺和重金属离子的顺序脱除:反应性吸附剂改性吸附剂的实用设计外文翻译资料
- 一种用于循环冷却水系统的阻垢剂性能评价外文翻译资料


