使用借氢法钌催化仲醇胺化反应
Kostiantyn O. Marichev 和 James M. Takacs*
联系方式:Department of Chemistry, University of Nebraska Lincoln, Lincoln, Nebraska 68588-0304, United States
摘要:一个新的钌络合物通过借用氢途径催化伯醇和仲醇的胺化以及二醇的区域选择性单-和顺序二胺化。氨基醇,二醇和二胺的新的分子内和分子间环化的几种变化导致杂环系统。
关键词:钌配合物,胺化,借氢,杂环合成
引言
醇是广泛可用于合成的原料,但通常需要化学计量活化以用于经典取代反应。使用过渡金属催化通过胺直接取代醇,特别是通过“借用氢”(BH)途径1(图1),利用原位活化的方法,提供了优于其他取代方法的显著优点。BH,该方法也称为氢自转移,催化循环涉及初始金
图1 钌催化BH法胺化1-苯乙醇
属催化脱氢开始以形成中间羰基化合物,然后其与胺进行加成-消除反应以形成相应的亚胺和水。在脱氢步骤中产生的氢可以还原亚胺,得到所需的烷基化胺产物。尽管形式上是一个多步骤过程,但BH反应相对“绿色”;它们具有原子效率高,在一锅中进行,水是唯一的副产物。
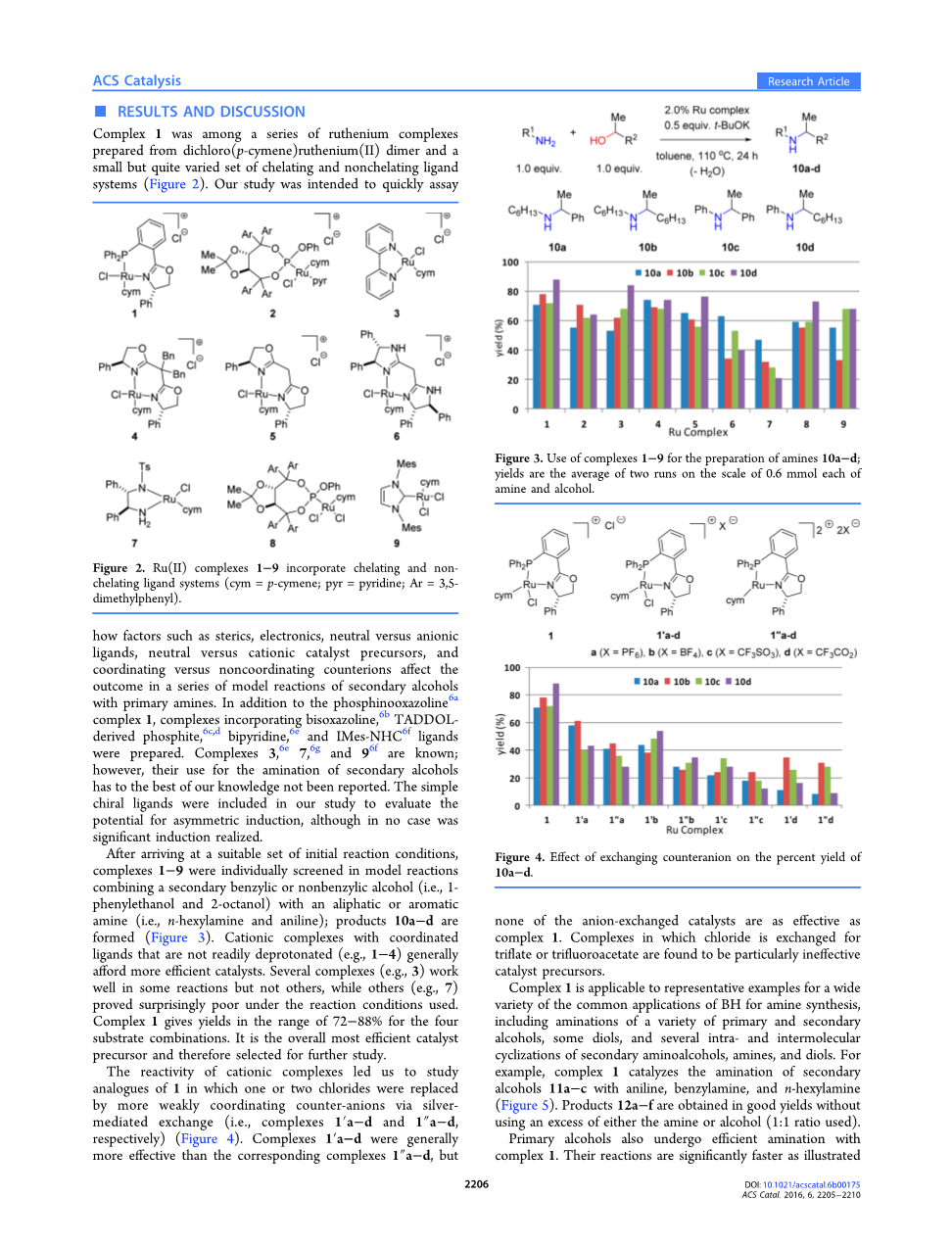
BH酰胺化2和胺化通常由钌3或铱4配合物催化,较少见于其他过渡金属配合物。5钌催化BH胺化的范围可以通过开发需要较低催化剂负载量,表现出较宽底物范围的催化剂体系来显着改善,避免需要大量过量的醇或胺,并在更温和的温度和更短的反应时间下操作。我们特别感兴趣的是开发钌催化剂,其广泛有效地用于仲醇的胺化,与伯醇的容易胺化相比,这一方面仍然不够成熟发达。
Beller及其同事3aminus;c在2006年开始的一系列突破性报告中,报告了第一种用于仲醇胺化反应的有效钌催化剂。原型的仲醇底物是1-苯基乙醇,使用钌(0)十二羰基(Ru3CO12)与1-苯基-2-二环己基膦基吡咯(6 mol%Ru,2-5:1酒精:胺)的结合,可得到具有简单脂肪族胺的高产率的胺产物,但不含简单的芳胺3b,如苯胺等。Williams及其同事报道了使用2.5mol%二氯(pcymene)钌(II)二聚体和双(2-二苯基膦基苯基)醚(DPEphos)配体3g进行仲醇胺化反应的几个实例。后一种组合提供了相当通用并且有效的BH催化剂体系。然而,通常仅在二甲苯回流条件下(5mol%Ru,150℃,24小时)才能实现与简单仲醇的高转化率。在目前的研究中发现,空气稳定的钌(II)配合物1在2.0%或更低的催化剂负载量和1:1的醇与胺的比例条件下,能够有效提高脂肪族和芳香族胺与1苯乙醇(和各种更复杂的醇)的转化率。
结果与讨论
配合物1是一种由二氯(对伞花烃)钌(II)二聚体和一组小但变化很大的螯合和非螯合配体体系制备的一系列的钌的配合物(图2)。我们的研究旨在快速分析空间位阻,电子,
图2 Ru(II)配合物1-9掺入螯合和非螯合配体体系(cym=对伞花烃;pyr=吡啶;Ar=3,5二甲基苯基)。
中性与阴离子配体,中性与阳离子催化剂前体,配位与非配位抗衡离子等因素是如何影响仲醇与伯胺的一系列模型反应的结果。除了膦酰恶唑啉6a络合物1之外,还制备了掺入双恶唑啉,6b亚磷酸酯,6c,dalpha;,alpha;lsquo;-双吡啶,6e和IMes-NHC6f配体的络合物。配合物3,6e 7,6g和96f是已知的;然而,据我们所知,它们用于仲醇胺化反应的用途尚未有过报道。我们的研究中还包括简单的手性配体,用以评估不对称诱导的可能性,尽管在任何情况下都没有实现发生显著的诱导。
一组合适的初始反应条件达到后,再结合仲苄醇或非苄醇(即1-苯乙醇和2-辛醇)与脂肪族或芳香族胺(即正己胺和苯胺)的模型反应,分别筛选配合物1-9;形成产物10a-d
(图3)。具有不易去质子化的配位配体的阳离子配合物(例如1-4)通常产生更有效的催化剂。几种配合物(例如3)在一些反应中工作良好但在其他反应中不起作用,而其他配合物(例如7)在所用反应条件下证实效果令人惊讶地差。配合物1给出的四种底物组合的产率在72-88%的范围内。它是总体上最有效的催化剂前体,因此被选择用于进一步研究。
阳离子配合物的反应性使我们研究了1的类似物,其中一个或两个氯化物通过银介导的交换被更弱配位的抗衡阴离子取代(即,分别为配合物1a-d和1a-d)(图4)。配合物
图3.使用配合物1-9制备胺10a-d;产率是胺和醇各0.6mmol下的两次运行的平均值。
图4 交换抗衡阴离子对10a-d收率的影响
1a-d通常比相应的配合物1“a-d更有效,但是没有一种阴离子交换的催化剂与配合物1一样有效。我们还发现当氯化物交换为三氟乙酸盐或三氟乙酸盐的配合物时是完全无效的催化剂前体。
络合物1适用于BH在胺合成的各种常见应用中的代表性实例,包括各种伯醇和仲醇、一些二醇的胺化,以及仲氨基醇、胺和二醇的几种分子内和分子间环化。例如,配合物1催化仲醇11aminus;c与苯胺、苄胺和正己胺的胺化反应(图5)。产品12aminus;f在不使用过量胺或酒精(使用1:1比例)的情况下获得了良好的产率。伯醇也与络合物1进行有效的胺化反应。
如1,2-丙二醇(13a)、1,3-丁二醇(13b)和1,4-戊二醇(13c)与一当量苯胺或苄胺的区域选择性胺化反应所示,它们的反应速率明显更快。相应的氨基醇14的产率高,并且具有良好的区域选择性(图6);1.0%的配合物1足以支持有效转化。Beller及其同事以前曾报道过
图6。二醇13aminus;c的区域选择性单二胺化和顺序二胺化。
1-苯基-1,2-乙二醇[(2 mol%Ru3CO12和N-苯基-2-(二环己基膦酰基)吡咯(CataCXium PCy)]的区域选择性胺化反应,尽管苯胺的最大产率为55%。7同样,Oe也报道了1-苯基-1,2-乙二醇与仲胺的区域选择性胺化反应(5 mol % Ru and (S,R)-Josiphos)。8
分离的氨基醇14a、14b和14e用于仲醇反应来合成二胺15a-f。值得注意的是,脂肪胺和芳香胺的第二次胺化反应都是成功的。此外,实验数据表明芳胺反应物中适度的吸电子或给电子取代基是可以容忍的。二元醇与胺经BH缩合生成简单氮杂环是有先例的。我们发现,苄胺与1,4-戊二醇(13c)的1:1反应生成N-苄基-2甲基吡咯烷(16),产率高(69%)(式1)。
图7显示了通过氨基醇179的BH环化形成五元和六元杂环的其他实例。17a的适当取
代衍生物环化为2,4,4-三取代吡咯烷18和19以及2,5-二取代吡咯烷20;后者,分离为磺酰胺衍生物,以顺式到反式的非对映体的4:1混合物形式产生。2-苯基吲哚(21)以优异的产率(94%)从其氨基醇的前体中产生;然而,可能由于其芳香性,BH反应在吲哚阶段就停止而不会经历进一步的还原。以伯氨基醇和仲氨基醇为原料制备吲哚的方法学已有报道。4a据我们所知,我们的报告是第一个使用钌催化剂的补充示例。Kempe10、Milstein11、和Beller12报道了合成芳香氮杂环(例如吡咯、吡啶和嘧啶)的其他多组分脱氢缩合反应。配合物1还从具有17b所示核心结构的适当取代的氨基醇得到六元环饱和杂环,即2-甲基吗啉(22)和二氢苯并恶嗪衍生物23和24。
手性哌嗪类化合物是生物活性化合物全合成的重要组成部分13,已被用于自组装配位聚合物柔性配体的设计。14山口及其同事报道了铱催化乙醇胺衍生物的环二聚反应。15我们报道了钌催化BH法用于环二聚制备手性氨基醇的第一个实例。(S) -苯甘醇(25a)和(S)-苯丙氨酸醇(25b)二聚以高收率得到手性顺式-2,5-二取代哌嗪(式2)。在反应过程中,我们没有看到立体中心alpha;-氮差向异构化的证据;通过手性HPLC分析判断,哌嗪26a和26b基本上是单一对映体。
二胺与二醇的交叉偶联为合成哌嗪提供了另一条途径(图8)。Madsen及其同事报道了
铱催化邻二胺与邻二醇的环缩合反应。16虽然可以进一步优化反应条件,但使用标准条件的配合物1进行BH环化反应,迄今为止仅为中等效率;1,2-丙二醇(13a)与所需二胺的反应可获得约40%产率的2-甲基哌嗪(28)和四氢喹喔啉29。相比之下,1,4-戊二醇(13c)1,2-苯二胺在1,2,3,4-四氢苯并[b][1,4]重氮嗪衍生物30中形成8元环的反应产率则更高(78%)。但是,BH环二聚反应不能产生完全还原的产物。
结论
总之,钌(II)络合物1有效地催化了多种伯醇和仲醇与烷基胺和芳基胺的BH胺化反应,包括二醇的区域选择性,单二胺化和顺序二胺化。还证明了氨基醇、二醇和二胺的分子内和分子间BH环化反应的几种变体。后者产生五元和六元环杂环,一种情况下产生八元环杂环。
实验部分
在300或700 MHz Bruker Avance III HD NMR光谱仪上记录NMR光谱,使用残留物CDCl3(delta;7.26 ppm)或H2O(delta;1.56 ppm)作为1H NMR参考。中心CDCl3共振(delta;77.16 ppm)用作13C NMR参考。1H NMR谱报告如下(s=单重态,d=双重态,t=三重态,q=四重态,p=五重态,m=未分辨多重态)。在ISCO 2360型HPLC上使用Daicel Chemical Industries,Ltd.Chiralcel OJ-H和Chiralpak AD或IC柱(0.46times;25 cm)进行手性HPLC分析。用ChromPerfect色谱分析软件(5.1.0版)对数据进行记录和分析。使用Avatar 360 FT-IR记录红外光谱。以二氯甲烷或氯仿溶液的形式测量旋光度,并使用Autopol III自动旋光仪记录旋光度;浓度c以g/100 mL表示。
氯(对甲苯)[(S)-2-(2-(二苯基膦酰基)苯基)-4-苯基-4,5-二氢恶唑]氯化钌(II)(1)。二氯(对甲苯)钌(Ⅱ)的混合物(6.1毫克,0。在室温下将10 mL甲醇中的1 0 m m o l)a n d(S)-2-(2(二苯基膦酰基)苯基)-4-苯基-4,5-二氢恶唑(81 mg,0.20 mmol)搅拌3 h。蒸发溶剂。硅胶上的硅胶快速层析得到钌(II)络合物1(128 mg,90%),呈橙色固体:mp 116minus;118°C;Rf=0.4(二氯甲烷/甲醇9:1);[alpha;] D25 = 183.8 (c 0.67, CH2Cl2); 1H NMR (700 MHz, CDCl3) delta; 8.15 (dd, J = 9.8, 4.2 Hz, 1H), 7.77 (dd, J = 10.5, 7.7 Hz, 2H), 7.62minus;7.54 (m, 12H),
7.48minus;7.42 (m, 2H), 7.38minus;7.35 (m, 2H), 6.31 (dd, J = 7.0, 3.5 Hz, 2H), 5.70 (t, J = 4.9 Hz, 1H), 5.56 (d, J = 6.3 Hz, 1H), 4.95 (t, J = 9.8 Hz, 1H), 4.61 (dd, J = 9.1, 4.2 Hz, 1H), 4.44 (d, J = 6.3 Hz, 1H), 2.67 (septet, J = 6.3 Hz, 1H), 1.17 (d, J = 7.0 Hz, 3H), 1.08 (s, 3H), 0.80 (d, J = 7.0 Hz, 3H) ppm; 13C NMR (175 MHz, CDCl3) delta; 167.8 (d, J = 5.3 Hz), 139.4, 134.0, 133.9, 133.4, 133.3, 132.1, 131.7, 131.5, 129.5, 129.4, 129.3, 128.9, 128.8, 127.6, 76.6, 76.0, 31.0, 22.7, 20.1, 16.8 ppm; 31P NMR (283.4 MHz, CDCl3) delta; 34.8 ppm; ; IR (neat) 3366, 3052, 2160, 2031, 1599, 1434, 1093, 729, 696 cmminus;1; HRMS (ESI) calcd. for C37H36NOP35Cl96Ru [(Mminus;Cl) ], 672.1299; found, 672.1306 m/z.
二级反应的样品程序
乙醇:N-(1
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[270786],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 选择性能量转移催化烯烃的含硼几何异构化外文翻译资料
- 瑞德西韦阻滞SARS-CoV-2聚合酶的作用机理外文翻译资料
- 铱催化的共轭二烯的C-H烯基的烯丙基化反应外文翻译资料
- 铱和布朗斯特酸协同催化烯丙醇对萘酚衍生物的对映选择性脱芳构化外文翻译资料
- 新型选择性MT2受体配体2-(苯硫基)苯并[b]噻吩类化合物的制备和药理学评价外文翻译资料
- Ilimaquinone是一种海绵代谢产物,通过gadd153介导的途径发挥抗癌作用外文翻译资料
- 用环境敏感药物释放的三氧化二砷靶向介孔二氧 化硅纳米颗粒有效治疗三阴性乳腺癌外文翻译资料
- 复方中草药对雄性荷斯坦犊牛生长表现,胴体特征和肉质的 影响外文翻译资料
- 线粒体在没有人体ATP合酶的亚基c时渗透性转 变的持久性外文翻译资料
- 基于呋喃类化合物构建环氧树脂 2,5-呋喃羧酸(FDCA)生物基环氧树脂的合成及性能研究外文翻译资料


