
英语原文共 13 页
摘要:纳米金属有机骨架材料是一种具有广泛应用前景的生物医用材料。由于NMOF的化学多功能性、巨大的多孔性和可调降解性,它们已被用作传输成像和/或治疗货物的载体。然而,大多数nmofs的相对较低稳定性限制了其在体内的实际应用。在这里,我们报告了一种具有放射性的uio-66 nmof(89zr-uio-66)的生产和特征,其中加入了发射正电子的同位素锆-89 io-66,进一步实现了功能化与芘衍生聚乙二醇(py-pga-peg)结合并与一个肽配体(f3)结合到核苷上,用于三阴性乳腺肿瘤的靶向治疗。阿霉素(DOX)以较高的载药量(1 mg DOX/mg UIO-66)加载到UIO-66上,作为本研究的治疗载体和荧光观察仪。功能化89ZR-UIO-66在不同的生物介质中表现出较强的放射化学和材料稳定性。根据细胞靶向和体内正电子发射断层扫描(PET)成像的结果,我们可以得出89ZR-UIO-66/PY-PGA-PEG-F3可以作为一种可引导肿瘤的选择性载物纳米平台。此外,毒性评估证实,适当聚乙二醇化的uio-66不会对受试者产生急性或慢性毒性。这种固有放射性的NMOF选择性靶向肿瘤血管和肿瘤细胞,在肿瘤治疗中有着广泛的应用。
金属有机骨架(MOF,又称多孔配位聚合物)是一类新兴的多功能材料,它是由金属离子或有机连接体(通过配位键)桥接而成的簇状结构, 与其他常规纳米材料相比,纳米级MOF(NMOF)具有多种优点:结构和组分可调性好(允许生产不同形状、尺寸和化学性质的NMOF), 有许多研究涉及使用NMOF材料作为体内癌症治疗剂。例如,一种基于铪-氯的NMOF被报道具有良好的结肠癌光动力疗法(PDT)的疗效。12最近,基于4-羧基苯基(4-羧基苯基)卟啉的NMOF被聚乙二醇化,并成功用于小鼠乳腺癌模型的PDT和放射治疗组合。13nmofs可用于不同癌症类型的组合治疗。各种治疗组合,如小干扰RNA(sirna)/化疗药物、14种双重化疗药物(如吉西他滨和奥沙利铂)、15种或化疗药物/pdt,16种已尝试用于体内肿瘤治疗,获得了令人鼓舞的数据。另一方面,尽管收集了令人信服的证据来证明nmofs可以很容易地用于多种成像技术,如计算机断层扫描(CT)、17磁共振成像(MRI)、18#39;19或光学成像,但迄今为止,使用nmofs作为体内肿瘤成像进行了20项非常有限的研究。
与其他成像技术相比,正电子发射断层扫描(PET)成像具有较高的检测灵敏度(低至皮摩尔范围)、更深的信号穿透(特别是与光学成像技术相比)和更好的定量能力,24因此在临床前和临床场景中得到了更广泛的应用。在这里,我们的目标是开发一个适用于生物相容性的NMOF平台。
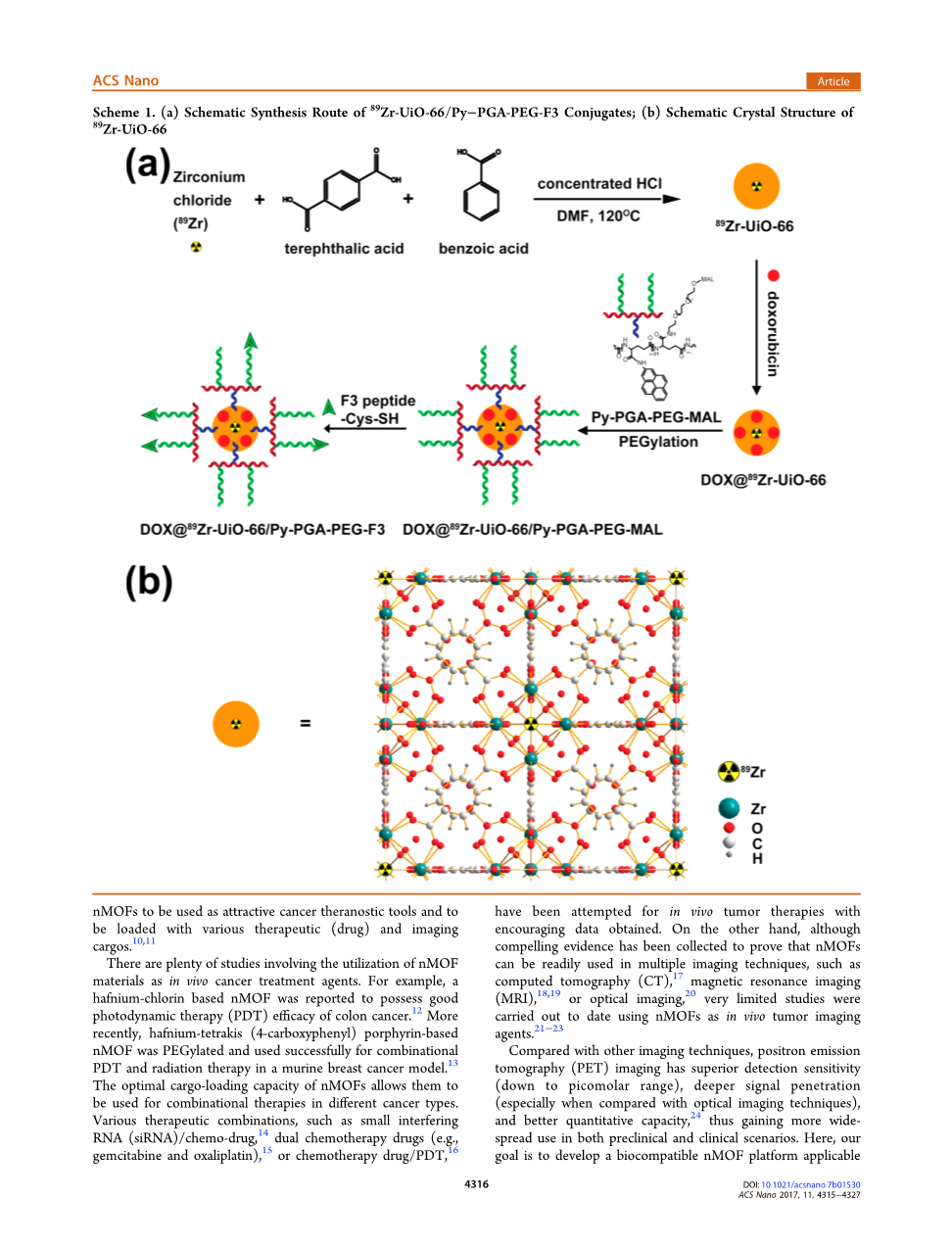
在PET成像和肿瘤靶向方面,为将来的PET引导货物运送癌症做准备。从现有的nmofs库中,选择了含有uio-66 nmof(1,4-苯二甲酸酯(bdc)和苯甲酸(ba)作为桥接连接体)的锆作为模板材料,因为它们以其最佳的表面积而闻名,以及一个独立于连接体、异常稳定的连接体。25#39;26此外,由于现有的Zr6O4(OH)4连接团簇、27个PET同位素Zr89(89Zr,=78.4h)28可以无缝连接。
在合成过程中并入UIO-66结构(方案1)。利用芘衍生聚乙二醇(PEG)29进行表面工程,不仅可以提高UIO-66在生物介质中的稳定性和分散性,还可以为肿瘤靶向整合提供进一步的功能化位点。
分子。同时,高孔结构的uio-66能够很好地适应亲水性和疏水性药物,它们的持续(长达30天),pH依赖性药物释放曲线已经被揭示。
本研究选择F3肽(kdepqrrsarlsakpappkpekpakka-pakk)作为肿瘤靶向配体,因为它在肿瘤血管中表现出与肿瘤细胞和活化内皮细胞的有效结合。32以前的一项研究表明,F3肽选择性地结合肿瘤(和活化内皮)细胞表面上的核仁蛋白,并与细胞表面的核仁蛋白结合。随后被转运到细胞核和细胞质中。33细胞表面核苷表达的升高是各种癌症细胞,特别是乳腺癌细胞的一个重要标志。34将半胱氨酸残基并入F3肽的C端,以促进其与uio-66 nmof的结合(通过与芘的硫醇-马来酰亚胺反应)。
将f3附着于uio-66(最终的结合物命名为uio-66/py-pga-peg-f3)后,进行体外分析(例如流式细胞仪、共聚焦荧光显微镜),以验证uio-66/py-pga-peg-f3对细胞核仁蛋白的靶向特异性。随后,对携带原位mda-mb-231肿瘤的小鼠进行体内PET成像、器官分布和组织学研究,以确定uio-66/py-pga-peg-f3的肿瘤靶向能力。将dox-orubicin(dox)加载到uio-66结合物上,作为抗癌模型药物和荧光团,以确定这些纳米结合物的位置。此外,还进行了一项原理性的体内给药研究,以验证静脉注射dox-loaded uio-66结合物后dox靶向给药效率的提高。通过适当的官能化从PY-PGA-PEG,这些UIO-66缀合物没有对BALB/c小鼠施加急性或慢性毒性,经组织学染色和血清生化分析证实。从这些实验数据推断,具有放射性的uio-66结合物显示出巨大的潜力,可用于未来的图像引导治疗和靶向癌症治疗。
结果和讨论
根据透射电子显微镜(TEM)测量(图1a和s1)和扫描电子显微镜(SEM)图像(图s2),合成的uio-66 nmofs由单个尺寸为50-90nm的八面体形状纳米晶体组成。27粉末X射线衍射(pxrd)分析证实成功获取了uio-66型nmof(图1e)。经聚(y-谷氨酸)-芘(30%)-聚(乙二醇)-马来酰亚胺(py-pga-peg-mal)和F3肽表面修饰后,uio-66聚合体(水溶液中最稳定的形式)的尺寸略有增加,从约220 nm(uio-66)到约250 nm(uio-66/py-pga-peg-f3)(图1a和s1)。成功的表面工程在动态光散射(DLS)和Z电位测量中得到进一步验证,如图1b和表s1所示。与合成的UIO-66相比,PY-PGA-PEG-MAL包衣后(Z电位:从37.6plusmn;0.5 mV到-5.18plusmn;0.05 mV)和F3肽附着后(Z电位:从-5.18plusmn;0.05 mV到-0.9plusmn;0.4 mV)的表面电荷有显著变化。
此外,还记录了uio-66/py-pga-peg-f3的FT-IR和1H NMR光谱以评估聚乙二醇化水平(图S3和S4)。来自uio-66(在〜1370 cm-1处)36和py-pga-peg的特征红外吸收峰(c-c和c-o拉伸的两个主要峰分别在〜1200 cm-1和〜1050 cm-1处)证实了与uio-66成功的py-pga-peg结合(图S3),与1H核磁共振结果一致(图S4)。根据uio-66/py-pga-peg-f3(图S5)的热重分析(TGA)结果计算,每mg uio-66中含有〜1.3 mg py-pga-peg-f3。UIO-66/PY-PGA-PEG-F3偶联物可在生理介质(水、盐水、DulbCur^ S修饰的EGO培养基[DMEM]和胎牛血清[FBS])中很好地分散,不可观察到聚集长达2周,而在UIO-66在生理盐水中分布2天内可见大量沉淀物(图S6~S8),WHI。CH进一步证实了聚乙二醇化的成功。发现uio-66/py-pga-peg-f3的水动力直径为255plusmn;10纳米(图1b)。
在UIO-66结构中加入89ZR,89ZR-UIO-66的比活度可达〜13.9mbq/mg,衰变校正放射化学产额为85.7plusmn;6.2%(n=3)。在PET成像过程中,对89ZR-UIO-66/PY-PGA-PEG在PET中的可检测性进行了体模研究。图1C显示了一个96孔板的PET图像,其中包含各种浓度的89ZR-UIO-66/PY PGA-PEG(0-20 yg/ml,每孔100mu;l)。UIO-66浓度与计算的放射性浓度之间的良好线性关系证实,从PET获得的量化数据真实地反映了89ZR-UIO-66/PY-P的量。GA-PEG共轭物。
稳定性评价:测定了UIO-66放射性同位素的稳定性和UIO-66/PY-PGA-PEG-F3的结构完整性。在全小鼠血清(图1d)孵育120小时后,89Zr的99.99%以上保持在89Zr—UIO-66/pY-PGA-PEG-F3上。同时,在DLS测量(图7)的基础上,在胎牛血清(FBS)孵育后,没有发现UIO-66/PY-PGA-PEG-F3的显著形态学改变。由于PET成像定位了放射性标记(此处为89ZR),而不是uio-66共轭物,因此良好的稳定性是来自PET的信号准确反映uio-66共轭物分布情况的前提。
为了充分制备用于体内应用的纳米材料,适当的功能化对于优化其在受试者体内的性能至关重要。我们选择Py-PGA-PEG作为uio-66的包衣/功能化剂,因为它可以与uio-66内的桥接有机分子(如bdc和ba)建立强大的N-N相互作用。尽管有报道称某些配体与nmof结构内的金属离子协调,但37,38我们认为这可能不是py的情况。
PGA-PEG从结构上看,Py-pga-peg(-f3)不是与uio-66内金属离子(zr)协调的强路易斯碱,特别是当pga主链上的大多数羧基已经与peg上的胺基反应时。py-pga-peg(-f3)上丰富的芘环使N-N的堆积更加合理。我们必须指出的一点是,一些Py-PGA-Peg(-f3)可以进入并占据uio-66的孔(至少部分),而不是仅仅作为“刷子”作用于外表面,因为它具有分子柔性。这可以从加载到uio-66上的大量py-pga-peg(-f3)得出(TGA分析中的1.3 mg-peg/mg uio-66)。为了使聚乙二醇化过程更具可控性,一种可能的解决方案是用共价改性方法代替N-N相互作用。
PXRD分析显示,在PY-PGA-PEG PEG化后,UIO-66的结构完整性在不同pH处理(5和7.4)、血清处理或货物(DOX)负荷下保持不变(图1E)。尽管uio-66 nmofs已经被用作药物载体27、31和成像造影剂,但39由于没有涉及体内给药,因此这些研究中没有对这种nmoff进行功能化。我们的研究结果从不同角度证实,uio-66/py-pga-peg结合物在各种生物介质中保持足够的稳定性,这鼓励我们继续研究它们在活动物中的分布情况。
DOX加载和释放。根据氮吸附-解吸等温线(图S9)测定,uio-66 nmof的比表面积相对较高,为988.625 m2/g,这证实了它适合装载各种货物。通过py-pga-peg-f3(图S9),功能化后的表面积减小到438.978 m2/g。根据对DOX 488nm处的吸光度测量,可载入UIO-66的DOX量计算为1 mg DOX/mg UIO-66。在37°C下,在5.0、6.8和7.4的模拟生理条件下,对dox@uio-66/py-pga-peg-f3的dox释放曲线进行测试。如图2c所示,中等pH对uio-66结合物的dox释放率产生影响。在pH7.4时,2周后可释放27.73%的DOX(0.27mg DOX/mg UIO-66),说明在生理条件下,UIO-66结构内的加载DOX相对稳定。
当暴露于模拟肿瘤细胞外pH值的6.8时,DOX的释放率在同一时间范围内提高到32.65%(0.33 mg DOX/mg UIO-66)。当培养基的pH值进一步降低到5.0时(类似于在4.5到6.5.40之间的细胞内室),2周后释放的DOX量增加到约37.06%(0.37 mg DOX/mg UIO-66)。这些数字证实了dox@uio-66/py-pga-peg-f3的dox释放是持续的和依赖于ph的,这与最近的一份报告一致。
这里的一个关键问题是dox在uio-66共轭物上的加载位置。DOX的分子量为15.3x 11.9a,19,似乎很难与uio-66(~11a八面体,~8a四面体)的微孔相匹配。27然而,本研究仍获得了较高的DOX载量(1mg DOX/mg uio-66)。DOX加载成功也可以通过DOX@uio-66/py-pga-peg-f3的表面积显著减少来确认(17.4975 m2/g,图S9)。在UIO-66中,DOX和有机连接体(例如,BDC)之间的N-N相互作用可以部分地促进这种良好的加载效率。赵等。结果表明,在核壳fe3o4@uio.66纳米平台中,DOX的负载能力比uio-66外壳的厚度大22。他们的观察表明,DOX不仅停留在uio-66的外表面上。一种可能是DOX可以经历一些分子变形进入uio-66孔,但需要进一步的实验证据来证明这一点,这将是我们未来的研究目标之一。
同时,我们必须承认,尽管uio-66/py-pga-peg-f3可以部分阻止DOX的过早释放。
在血液中(pH7.4),当癌细胞到达肿瘤细胞外区后,作为一种连续的药物释放源,杀死癌细胞,货物释放速度/效率有待进一步提高。同时,在培养后30分钟内释放~19%的载药DOX(所有ph组)。这种最初的“突发性”释放,可能是由于DOX从UIO-66的外表面泄漏(更容易受到环境变化的影响),可能对药物输送平台不利。为了解决这一难题,可能需要一个更具保护性的“封顶”系统(例如,使用脂质或其他刺激反应性聚合物)来进一步防止DOX过早释放,如在其他多孔纳米材料或其他类型的NMOF中所用。
体外肿瘤细胞靶向。两个细胞系用于体外评价uio-66结合物:mda-mb-231三联阴性乳腺癌细胞(核仁 )和L929成纤维细胞(核仁-)。Western blot用于确认这两个细胞中核仁蛋白的表达谱(图S10)。在这里,加载到uio-66/py pga-peg-f3或uio-66/py pga-peg上的dox用作荧光团,以指示这些纳米结合物的位置(图1d)。如流式细胞术和共聚焦显微镜检查所示,mda-mb-231细胞中dox@uio-66/py-pga-peg-f3的荧光强度明显强于dox@uio-66/py-pga-peg的荧光强度,而uio-66两个结合物的荧光主要分布在细胞质中(图2a,b
资料编号:[4429]
您可能感兴趣的文章
- 选择性能量转移催化烯烃的含硼几何异构化外文翻译资料
- 瑞德西韦阻滞SARS-CoV-2聚合酶的作用机理外文翻译资料
- 铱催化的共轭二烯的C-H烯基的烯丙基化反应外文翻译资料
- 铱和布朗斯特酸协同催化烯丙醇对萘酚衍生物的对映选择性脱芳构化外文翻译资料
- 新型选择性MT2受体配体2-(苯硫基)苯并[b]噻吩类化合物的制备和药理学评价外文翻译资料
- Ilimaquinone是一种海绵代谢产物,通过gadd153介导的途径发挥抗癌作用外文翻译资料
- 用环境敏感药物释放的三氧化二砷靶向介孔二氧 化硅纳米颗粒有效治疗三阴性乳腺癌外文翻译资料
- 复方中草药对雄性荷斯坦犊牛生长表现,胴体特征和肉质的 影响外文翻译资料
- 线粒体在没有人体ATP合酶的亚基c时渗透性转 变的持久性外文翻译资料
- 基于呋喃类化合物构建环氧树脂 2,5-呋喃羧酸(FDCA)生物基环氧树脂的合成及性能研究外文翻译资料


