
英语原文共 8 页,剩余内容已隐藏,支付完成后下载完整资料
甲壳素生物催化生产葡萄糖胺的生物膜介导多酶串联系统的设计
鲍晶晶、刘年、朱丽英、徐庆、黄和、江凌
南京工业大学生物与制药工程学院,南京210009
南京工业大学食品与轻工学院,南京210009
南京工业大学化学与分子工程学院,南京210009
南京工业大学药学院,南京210009
摘 要:甲壳素是生产葡萄糖胺(GlcN)的重要原料。在本研究中,我们采用从柯达卡拉热球菌KOD1中分离的三种关键酶催化alpha;-几丁质顺序转化为GlcN,并开发了一种固定在细菌生物膜中的多酶组装级联(MAC)系统,实现了多步一锅反应。具体来说,SpyTag-SpyCatcher和SnoopTag-SnoopCatcher对提供共价和特异结合力,将酶逐个固定在生物膜上,并组装紧密的酶级联。MAC体系具有很强的催化活性,用少量的副产物将79.02plusmn;3.61%的alpha;-几丁质转化为GlcN,是纯酶催化GlcN的2.09倍。该体系具有良好的温度稳定性和pH稳定性。值得注意的是,在6轮重复使用后,90%的酶活性得以保留,而在17轮重复使用后,仍有可观的酶活性。
关键词:甲壳素、葡萄糖胺、生物膜、SpyTag-SpyCatcher、SnoopTag-SnoopCatcher、多酶组件
一、绪论
葡萄糖胺(Glucosamine,2-氨基-2-脱氧-D-葡萄糖,GlcN)存在于所有生物体中,是合成肽聚糖和脂多糖等细胞壁成分的重要前体[1,2]。 它还可作为细菌生长的替代碳源[3]。GlcN已被用作食品等多个领域的良好添加剂[4,5],制药[6]、化妆品[7]、和农业工业[8]。特别是,它作为治疗骨关节炎的营养补充剂销售[9]。欧洲、亚洲和拉丁美洲国家批准葡萄糖胺作为医疗产品,导致对产量和质量良好的葡萄糖胺制剂的需求日益增加。甲壳素是由乙酰化形式的GlcN、[10-12]和alpha;-甲壳素聚合而成,主要从贝类中提取,是生产GlcN的重要原料。[13,14]目前,酸水解工艺最适合工业化生产GlcN。甲壳素粉末在大约100°C的温度下用高浓度酸溶液回流。[15]尽管反应简单且容易在水酸中发生,但它对环境造成的巨大威胁阻碍了它的发展。在这种情况下,微生物方法变得越来越有吸引力。微生物发酵法生产葡萄糖胺的研究已有几十年的历史,但以葡萄糖为底物,以alpha;-几丁质为起始底物,[16-19]和无发酵为研究对象。然而,分离的酶在用alpha;-几丁质作为底物生产GlcN时是很好的替代品。从不同来源分离的不同种类的几丁质酶参与几丁质的降解,如内切几丁质酶(酶代码EC3.2.1.14)[20,21]、外切几丁质酶(酶代码EC3.2.1.200)[22,23]、beta;-N-乙酰己糖胺酶(酶代码EC3.2.1.52)[24,25],N-乙酰-D-葡萄糖胺脱乙酰基酶(酶代码EC3.5.1.33)[26,27]、等。特别是酶制剂的高成本和产品的低质量和低产量,以及不同分子量和脱乙酰度的混合物[28]。酶固定化是生物催化中一种传统和有前途的方法,在许多方面优于分离酶,但是,由于载体和目标酶之间的相容性问题,这一过程仍然具有挑战性,这使得实现多酶固定化的目标相当困难[29,30]。工程化的、适应性强的平台和连接材料是将酶连接成级联的必要条件[31]。级联生物催化以一步一步的方式实现一锅式反应,已成功地应用于合成特种化学品和药物前体,以及将生物量转化为燃料和所需产品[32]。在过去几十年中,生物膜的研究增进了我们对细菌系统作为一种基因系统的理解可编程铸造[33-35]。受自生细胞外生物膜特性的启发,一种针对产品的细胞表面固定化策略应运而生[36]。与靶酶锚定的工程生物膜可以作为可编程和模块化的细胞外生物合成材料和酶介导平台来实现级联生物催化策略。这样,天然固定化生物分子的微生物生物膜是可能的用于连续生物处理的解决方案,作为一种优雅、强大和廉价的细胞固定方法,无需添加任何聚合物或化学品[37]。
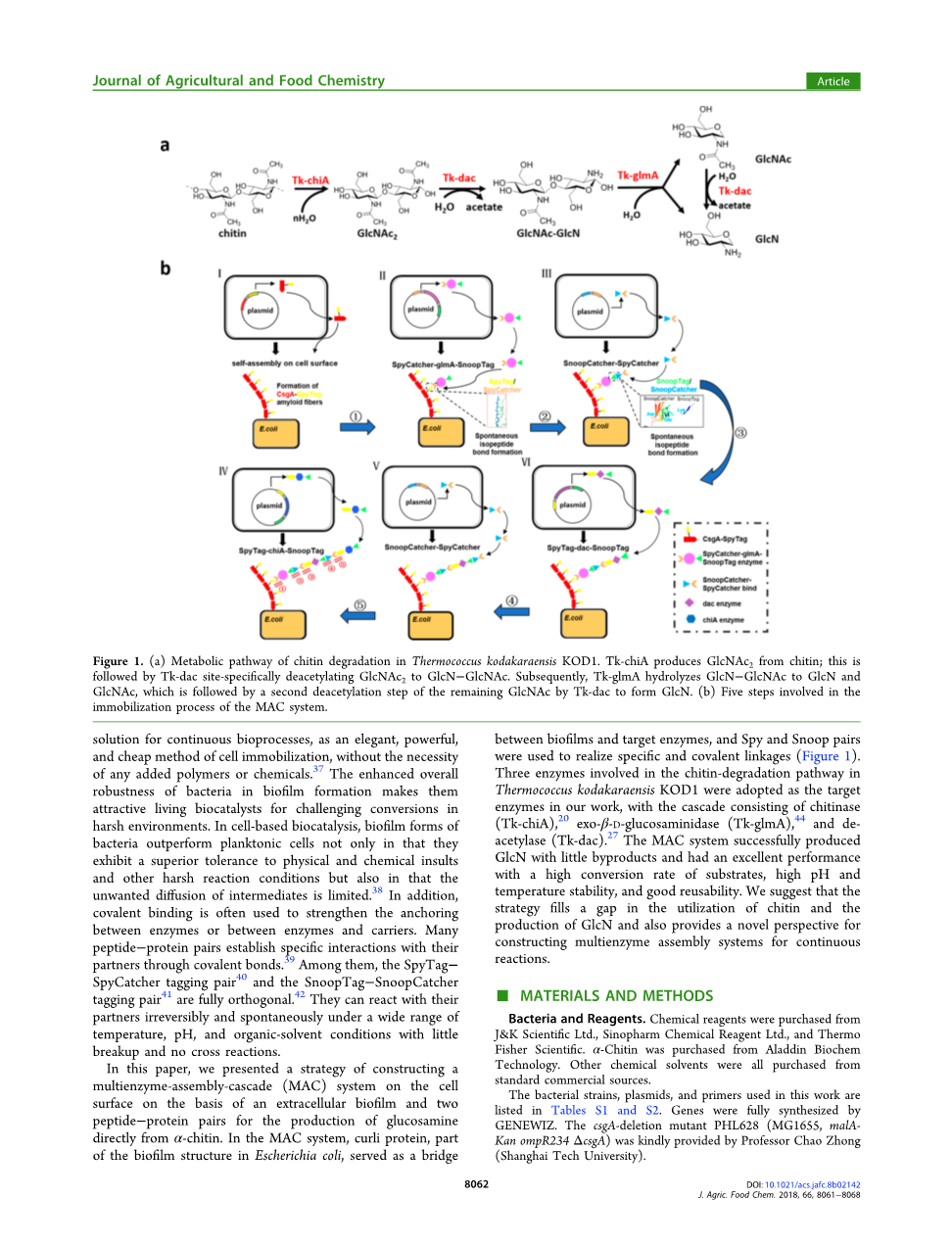
图1(a) kodakaraensis KOD1热球菌几丁质降解的代谢途径。Tk-chiA从几丁质中产生glcnac2;接着是Tk-dac位点,特别是去乙酰化glcnac2到GlcN-GlcNAc。随后,Tk-glmA将GlcN-GlcNAc水解为GlcN和GlcNAc,随后由Tk-dac对剩余的GlcNAc进行第二脱乙酰化步骤以形成GlcN。(b) MAC系统的固定化过程涉及五个步骤。
细菌在生物膜形成过程中增强的整体鲁棒性使它们成为在恶劣环境中具有挑战性转化的有吸引力的活生物催化剂。在以细胞为基础的生物催化中,细菌的生物膜形式不仅表现出对物理和化学损伤以及其他恶劣反应条件的优越耐受性,而且还表现出对中间产物不必要的扩散是有限的[38]。此外,共价结合经常被用来加强酶之间或酶与载体之间的锚定。许多肽-蛋白质对通过共价键与伴侣建立特定的相互作用[39]。其中,SpyTag-SpyCatcher标记pair[40]和SnoopTag-SnoopCatcher标记pair[41]是完全正交的。[42]它们可以在广泛的温度、pH值下与伴侣发生不可逆和自发的反应,有机溶剂条件下,几乎没有破碎和交叉反应。
本文提出了一种在细胞外生物膜和两对肽-蛋白对的基础上,在细胞表面构建多酶组装级联(MAC)系统的策略,以直接从alpha;-几丁质生产葡萄糖胺。在MAC系统中,大肠杆菌生物膜结构的一部分curli蛋白充当了生物膜和目标酶之间的桥梁,Spy和Snoop对用于实现特定和共价连接(图1)。本研究以三种参与柯达卡拉热球菌柯达1几丁质降解途径的酶为目标酶,以几丁质酶(Tk-chiA)、20exo-beta;-D-葡萄糖苷酶(Tk-glmA)为串联酶,[44]和脱乙酰基酶(Tk-dac)27mac系统以少量的副产物成功地制备了GlcN,具有底物转化率高、pH值和温度稳定性高、重复使用性好等优良性能。我们认为该策略填补了甲壳素利用和GlcN生产的空白,为构建多酶连续反应组装体系提供了新的视角。
二、材料和方法
细菌和试剂
化学试剂购自Jamp;K科学有限公司、国药化学试剂有限公司和赛默飞世尔科技公司。alpha;-几丁质购自阿拉丁生物化工技术公司。其他化学溶剂均从标准商业来源购买。
表S1和表S2列出了本研究中使用的菌株、质粒和引物。基因完全由GENEWIZ合成。csgA缺失突变体PHL628(MG1655,malAKan ompR234Delta;csgA)由上海理工大学赵忠教授提供。
图2用考马斯染色法进行SDS-PAGE分析(a)CsgA-SpyTag,(b)SpyCatcher-glmA-SnoopTag,(c)SnoopCatcher-SpyCatcher,(d)SpyTag-dac-SnoopTag,(e)SpyTag-chiA-SnoopTag。请注意,SDS-PAGE的正常装载量不足以满足curli的要求,因此我们将装载量(a,2号通道)增加了一倍。
扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察
采用JEOL 1200透射电子显微镜(JEOL)进行透射电镜分析。将细胞样品(5mu;L)浸泡在铜网格上,然后用微孔水洗涤,并用1%磷钨酸染色。
采用JEOL-JSM-7600F扫描电子显微镜(JEOL)进行扫描电镜分析。将细胞样品与2%多聚甲醛/2.5%戊二醛在PBS(pH7.0)中混合,在4℃下孵育12h,然后在微孔H2O中洗涤,最后在乙醇浓度增加的梯度下脱水。样品在金溅射前冷冻干燥,在15kv加速电压下进一步分析。
胶体几丁质的制备
为了使几丁质更易溶解,将10 g几丁质与500 mL 85%磷酸混合,并在4℃下搅拌24小时。使用蒸馏水(5 L)溶解悬浮液;然后在12 000 g下离心10分钟。用蒸馏水洗涤沉淀,直到pH值达到5.0,最后用氢氧化钠缓冲液将pH值调节到7.0。将溶液离心并用3L蒸馏水洗涤以脱盐。沉淀在蒸馏水中再悬浮至最终浓度2%(w/v)[20]。
蛋白质表达与纯化。用编码csgA-SpyTag的pET-28a 质粒转化csgA缺失突变体(空白pET-28a 质粒作为对照组)。种子培养物最初在37°C下用卡那霉素(Kan,50mu;g/mL)在LB培养基中培养12h,然后通过离心收集细菌并在添加1 mM mgSO4和0.2%w/v葡萄糖的M63培养基中重新悬浮。细菌在30°C和180 rpm下生长;随后用0.3 mM异丙基-beta;D-硫代半乳糖苷(IPTG)诱导20 h。随后,培养物在30°C下静态培养24 h,以促进淀粉样聚集。通过离心收集的细胞颗粒,用50 mM pH7.0磷酸盐缓冲液洗涤,然后重新悬浮以进一步分析和固定化。E、coli BL21(DE3)细胞(Vazyme Biotech Company,Ltd.)用表达其他靶酶的重组质粒进行转化,详情见支持信息。
酶活性测定
以4-甲基伞形烯基-beta;-DN,N′,N〃-三乙酰基壳聚糖(GlcNAc3-4MU;Harveybio公司)为底物,采用荧光法测定Tk-chiA酶的活性。用SpectraMax M3平板阅读器测定了4-甲基伞形酮(4MU)的荧光,激发波长为350 nm,发射波长为440nm。将含有100mu;L o f 1 M M GlcNAc3-4MU和0.3mu;g Tk-chiA的反应混合物(1 mL)在50 mM醋酸钠缓冲液中孵育20 M in。在本试验的反应条件下,1单位(U)Tk-chiA相当于每分钟产生1mu;M还原糖的酶的量。
以4-甲基伞形烯丙基N-乙酰-beta;-D-氨基葡萄糖(GlcNAc-4MU)为底物,测定了Tk-dac的活性。以过量的Tk-glmA为偶联酶,在250mu;L of 1 0mu;M GlcNAc4MU、50mu;g Tk-dac和50 M M醋酸钠缓冲液中反应20分钟。一单位(U)Tk-dac被定义为每分钟产生1mu;M GlcN的酶的量。
以4-甲基伞形烯丙基beta;-D-葡萄糖苷(4-MUG)为底物,测定Tk-glmA的活性。将含有500mu;L o f 10mu;M 4杯、40mu;g Tk-glmA和50 mM醋酸钠缓冲液的反应混合物(1 mL)孵育20 min。1单位(U)Tk-glmA定义为每分钟水解1mu;M GlcN的酶的量。
通过中间产物的产生,测定了三种酶在形成三元酶级联反应后的催化活性。用预处理的甲壳素测定MAC体系的酶活性,并用高效液相色谱法(HPLC)对GlcN、二乙酰半乳糖(GlcNAc2)和Nacetyl-D-葡萄糖胺(GlcNAc)进行分析。将反应混合物的上清液在65℃下装载到Bio-Rad Hercules HPX-87H高效液相色谱柱上,并以0.6毫升/分钟的流速用5毫米硫酸洗脱。使用差示折射检测器(岛津公司)对产物进行鉴定。
几丁质酶法合成GlcN
将含有5g几丁质和20mg重组MAC系统的1l反应混合物孵育0、1.5、3、4.5、6、9、12和18h,取溶液样品,用HPLC进一步分析GlcN和中间体。对于改进的MAC系统,除了添加23mg三元酶级联外,在相同条件下进行反应。MAC系统转化率的计算基于以下公式:
其中,mGlcNand-mchitinar分别为GlcN的产物和alpha;-甲壳素的底物的重量,mGlcNand-mchitinar分别为GlcN(179.17 g/mol)和alpha;-甲壳素(221.21 g/mol)的相对分子量(MWs)。在alpha;-几丁质脱乙酰度为0的条件下,alpha;-几丁质的相对分子量为alpha;-几丁质重复单元的分子量。
MAC系统的可重用性测试
在250毫升锥形烧瓶和50毫升反应混合物中,在14小时催化循环下重复利用MAC系统。每批完成后,用锚定多酶级联离心混合物以收集细菌生物膜。在接下来的几轮催化中,将胶体甲壳素再次添加到反应混合物中。
三、结果和讨论
锚定在功能性淀粉样纤维上的MAC系统的设计
我们的策略旨在建立基于标记系统和细胞外基质的酶块。卷曲蛋白由csgA基因编码,是许多肠杆菌产生的复杂细胞外基质的主要成分。
图3 扫描电镜和透射电镜图像显示了重组质粒pETCsgA(b,d,f)和对照菌株PHL628表达的卷曲纤维的微观结构
表1 pET-chiA、pET-dac和pETglmA的动力学性质
每个实验进行三次独立的实验。反应条件为pH7和75°C。苯酶用带肽蛋白标记的重组质粒表达。CTPET-chiA、pET-dac和pET-glmA的酶活性单位(U)分别定义为每分钟产生1mu;M GlcNac2、每分钟产生1mu;M GlcN和每分钟产生1mu;M GlcN的酶的量,在这些分析条件下。CsgA蛋白过度表达后,单体从细胞内分泌,在细胞外组装成纤维。此外,SpyTag是一种13氨基酸肽,在遇
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[254397],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- Eupholides A− H,来自大戟根部的松香烷二萜类化合物及其生物活性外文翻译资料
- 响应面法优化杨花总黄酮含量外文翻译资料
- 乳酸链球菌*属保加利亚乳杆菌中β-半乳糖苷酶基的构建和分泌表达外文翻译资料
- 高温胁迫对淡水藻类四尾栅藻的生长及其热激蛋白表达的影响外文翻译资料
- α-萜品醇对绿霉的生长和形态的影响外文翻译资料
- 柑橘精油对意大利青霉和绿霉的抗真菌活性研究外文翻译资料
- Erigeroflavanone(一种来自灯盏花的新化合物)对培养的小鼠系膜细胞中过氧化氢损伤而诱导细胞死亡的保护作用外文翻译资料
- 响应面法优化蛹虫草类胡萝卜素抗氧化剂的酶辅助提取工艺外文翻译资料
- 水稻中低植酸种质的描述和研究(栽培稻)外文翻译资料
- 蜜蜂研究所在蜂胶多酚类成分的提取鉴定方面取得新进展外文翻译资料


