
英语原文共 10 页,剩余内容已隐藏,支付完成后下载完整资料
高效酶级联催化体系的合理设计
(Toward Rational Design of High-efficiency Enzyme Cascades, Yifei Zhang and Henry Hess*, ACS Catal. 2017, 7, 6018minus;6027)
1.引言
将部件从一个工作站传递到另一个工作站,以一种类似于流水线的方式组装分子是非常有吸引力的。实现这种多步反应控制的关键要求是能够控制中间体从反应位点到反应位点的运输。生物学利用区域化、代谢和支架来指导催化级联反应的酶之间中间体的转移。通常,中间体通过通道或接口从一个活动位点“连通”到另一个活动位点。纳米技术的最新进展使仿生结构设计能够以纳米级精度在DNA或蛋白质支架上对酶进行空间组织,并且已经观察到产量提高。它被认为是由酶之间的中间产物在近距离(接近通道)加速运输引起的[1-4]。现在出现了越来越复杂的结构,如纳米笼[5]、聚合物[6]、甚至桥接级联酶[7],以促进人工系统中中间体的转移。然而,加速产物形成的机理仍受到广泛的争论。Wheeldon等人已经全面总结了底物通道的生物学概念,并在两篇优秀的综述中介绍了人工支架上酶级联反应的实例[8,9]。其他最新的综述集中在级联酶系统的体系结构上,或多或少接受了接近通道的假设[10-14]。在此,我们重申我们的观点(首次表达于2012年)[15-18],即级联活性的提高不是由于酶的接近引起的,并列举了支持这一观点的最新证据。我们特别强调了支架改变酶特性的证据。最后,我们总结了实现高效多酶级联反应的最新见解和由此产生的可行策略。
2.靠近不会增强酶级联反应的整体活性
2.1在自然界底物通道是因为限制而不是接近
天然底物通道现象在几种双功能酶和多酶复合物中被观察到(例如色氨酸合成酶[19,20],氨甲酰磷酸合成酶[21],胸苷酸合成酶-二氢叶酸还原酶[22])。这些结构具有物理隧道,可以通过疏水/亲水或静电相互作用引导中间分子流向下一个活性位点。在某些情况下,中间分子在瞬时异质二聚体之间也可以通过一个摇摆蛋白结构域或形成的动态界面进行有效转移[23,24]。物理或化学限制可以防止中间体逸出到大体积溶液中,从而创造了一个高的局部中间体浓度,增加通量。通道已通过变构通讯证明存在于自然界中,其效率可通过同步相关酶的催化循环而进一步提高[25]。尽管通道限制常常使所涉及的域彼此接近(例如,已发现的通道长度在2 - 10纳米范围内),其关键在于防止中间产物向主体溶液的逸出。
正如我们在第2.2节中详细讨论的那样,对于所有底物通道机制,如果级联酶的单个动力学不变,则在只含有酶和底物的溶液中产物形成的稳态速率不受影响[26-28]。然而,底物流通在复杂的胞内和胞外环境中是有益的,在这种环境中,逸出的中间体可能会因为环境和竞争反应所丢失。
2.2.无通道的顺序级联反应和辅酶再生级联的动力学研究
2.2.1.顺序级联反应
双酶级联的动力学可以用一个形象化的桶传水来说明(图1)。当两名工人通过中间蓄水池输水时,水龙头的初始流量取决于中间蓄水池的水位,但最终的流速受到较慢的工人的限制(我们假设这是第一个工人)。第二个水池的水量随着图1a中红色曲线的增加而增加。如果工人可以用绳子直接在彼此之间传递水桶,运输速度是恒定的,水量随时间线性增加(图1b中的绿色曲线)。当同时使用绳索和储水池传递漏水的桶时,充水的时间过程介于红色和绿色曲线之间(图1c)。然而,如果没有绳子,但有许多工人和水龙头,一旦水被倒入中间的蓄水池,就可以立即将水输送到水池(图1d)。因此,填充的时间过程(绿色虚线)类似于一个完美的通道。
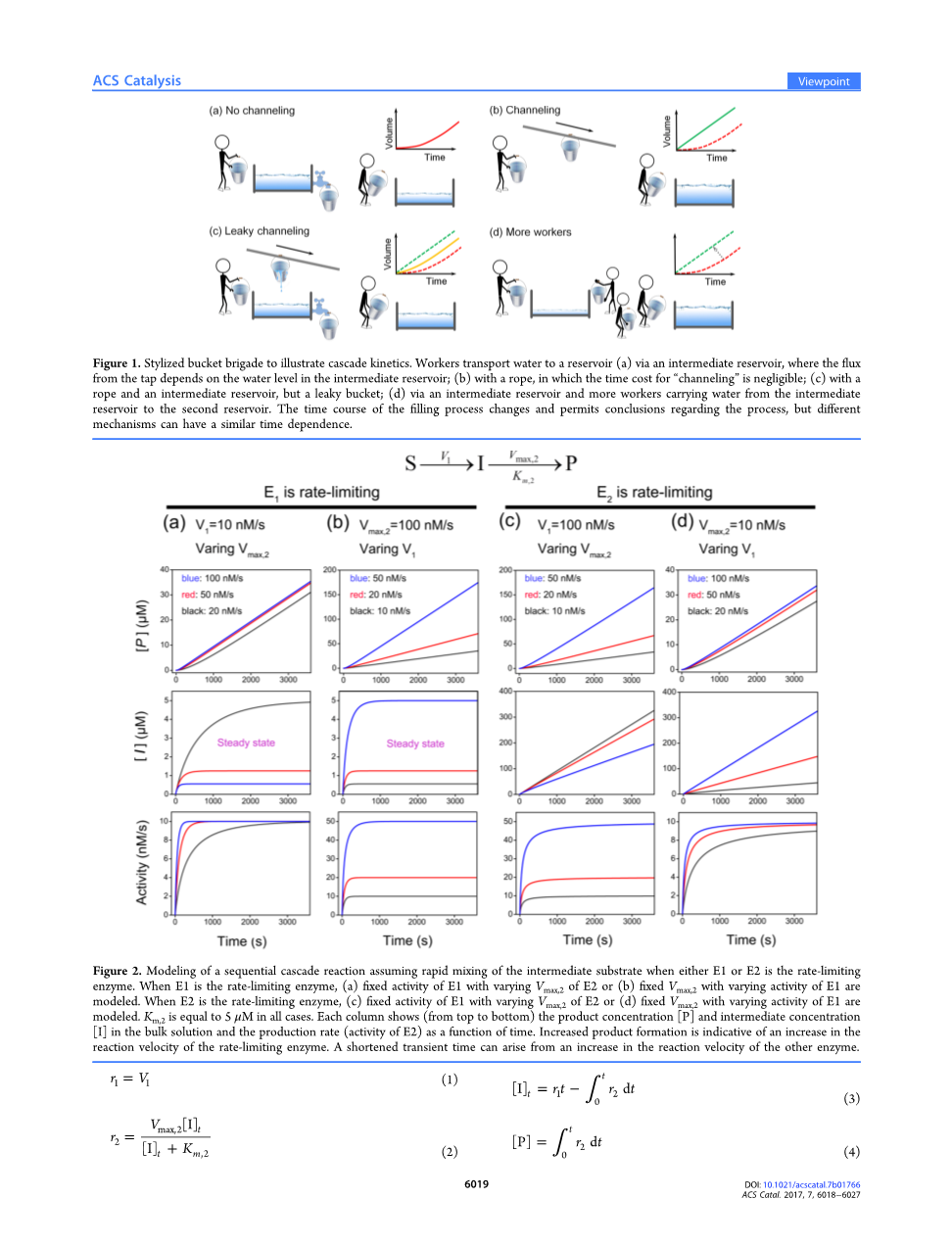
同样的逻辑也适用于连续的酶促反应。假定一个具有自由扩散酶的酶级联的简单模型(图2),其中酶1以恒定速度V1产生中间底物(Ⅰ),酶2遵循米氏动力学(Vmax,2和Km,2,假设Km,2=5 mu;M)。当底物1的浓度在级联反应中没有显著变化时,第一个假设是有效的。这种情况与图1a相对应,中间产物浓度的增加导致酶2的工作加速。若中间体浓度能在反应体积内瞬间达到平衡,整个反应过程可以用方程组来描述。
图1 通过桶传水过程形象的说明级联动力学。工人通过中间贮水池将水输送到(a)贮水池,水龙头的流量取决于中间贮水池的水位;(b)用绳子,则“通道”的时间成本可以忽略不计;(c)用绳子、中间贮水池和漏水的桶;(d)通过中间水池和更多的工人将水从中间水池输送到第二个水池。尽管填充的时间发生变化,但可以得出关于过程的结论:但不同的机制可能有相似的时间依赖性。
图2 当E1或E2是限速酶时,假设中间底物快速混合的顺序级联反应的模型。当E1是限速酶时,(a)E1的活性不随着E2的Vmax,2变化或(b)当Vmax,2不变时,对E1活性变化建立模型。当E2是限速酶时,(c)E1的活性不随E2的Vmax,2的变化而变化或(d)当Vmax,2不变时,对E1活性变化建立模型。Km,2在所有情况下都等于5 mu;M。每一列(从上到下)分别表示主体液中产物浓度[P]、中间产物浓度[I]和生产速率(E2活性)随时间变化的函数。产物形成的增加表明限速酶反应速度的增加。另一种酶的反应速度加快会导致瞬态时间缩短。
图2显示了不同反应速率v1和Vmax,2的顺序级联耦合动力学。所有反应的最终活性将受到到反应速度较慢的酶控制。只有当V1lt; Vmax,2时,中间产物浓度和生产速率才能达到一个恒定值的稳态(图2a,b)。增加非限速酶的活性只能缩短整个反应达到最大速度的时间,从而使生产提前开始(图2a,d)。相比之下,无论是上游还是下游,提高限速酶的活性都可以永久地提高整体生产效率(图2b,c)。图2a,d中的生产曲线很容易被误认为底物通道。特别是图2b,c中的使活性增加的生产曲线在形状上与一些DNA -支架酶级联的生产曲线相似。
2.2.2.瞬态时间vs通道时间
经典的瞬态时间定义为:级联反应中,中间体达到稳态通量所需的时间,只有当Vmax,2大于V1时才存在。实际上,瞬态时间可以通过图解法来估算(图3a)并且可被酶2的通道概率pc和反应概率pr所表达(tau;= (1minus;pcpr)Km,2/Vmax,2)[8,9]。底物通道可以通过缩短瞬态时间来识别(表示pc的增加)。但是如图2所示,这种现象因为可能是酶活性增加造成的,所以并不足以证实底物通道的存在。
图3 瞬态时间图和通道时间图:瞬态时间(tau;tran)可以通过产量与时间的关系曲线的反向延长线与时间轴的交点来估计。当于tau;tran接近于0,表示一个完美的通道相。(b) 对于“有漏洞”通道,E2的中间通量既来自直接通道,也来自整体溶液。因此,表观活度(绿色实线)是通道(黄色虚线)和主体溶液作用(蓝色虚线)的总和。当主体溶液流量等于通道流量时的时间点称为通道时间。
在我们看来,通道的特征是初始反应速率不为0,这是因为通道中间底物在几微秒内到达第二种酶(图3b)。随着时间的推移,来自主体溶液的第二种酶的中间体通量相对于通道增加,最终使通道无关紧要。为了捕捉这一过程,Idan和Hess引入了通道时间作为通道失去优势的时间点[16]。对于自由扩散的中间体且没有竞争反应的情况下,通道时间由以下方程表达:
其中,V为容器体积,D为底物分子的扩散常数,d为两种酶之间的距离。
该方程表明,通道时间与酶的动力学无关,而只与体系的几何结构和底物的扩散系数有关。典型地,对于在1 mu;m3体积中间隔10 nm的一个酶对(对应于1 nM的酶浓度),通道时间仅为10 ms,这表明在实验时间尺度上,接近的好处是可以忽略不计的。对于缓慢扩散的大分子底物(蛋白质、纤维素等)和高度稀释的酶(纤维小体等),接近通道作用可能更加明显。然而,这种作用是短暂的,稳态下的反应速率仍然受到较慢酶的限制。
一种常用的建模方法是利用扩散-反应模型计算酶附近反应物的浓度分布[8,29]。然而,中间体浓度的外边界条件通常设为零。在这种情况下,模型高估了接近通道效应,因为这种边界条件的选择忽略了间隔间的中间体浓度可以快速上升的事实。即使如此,在大多数情况下,接近还不足以提高总产量数倍,并且当酶间距离增加时,将很快失去其重要性。例如,Eun等人发现,当距离大于10 nm时,直接通道作用变得不重要[29]。这一结论与Bauler及其同事的布朗动力学模拟相一致,他们指出有效的通道作用仅在2.5 nm范围内发生[30]。同样,Wheeldon等人估计了从催化活性位点扩散的产物浓度[8]。对于速率为100 s-1的酶促反应和小分子底物(扩散常数为10-9 ㎡/s),活性中心的产物浓度并在微米级别的区域内无明显区别。
虽然有建模工作发现了显著的接近通道效应,但大多数都是在短时间内进行的。例如,Roberts等人的粗粒度布朗动力学模拟考虑了前4 ms, Chado等人的蒙特卡罗模拟模拟了137 ms[31,32]。因此,这些结果主要捕捉了初始“通道时间”阶段:然而,Chado等人在高酶密度下没有明显地观察到这种效应。
2.2.3.辅酶再生级联
酶级联的辅酶再生在许多生物合成过程中具有重要的应用价值,并且在支架上放置偶联酶的优点已经得到了广泛的证明[12,33,34]。同时,上述论点也适用于许多此类研究:(1)辅酶是小分子以致它们扩散太快而无法在酶的活性部位附近积聚(如NAD(P) /NAD(P)H);(2)当酶附着在支架上时,酶的活性是否发生改变尚不清楚。
图4 对于辅酶依赖的酶促反应,在没有辅酶再生(a)和有辅酶再生的情况下(b),主要反应物浓度随过程时间的变化的图解。如果底物2的初始浓度相对于(b)增加,平衡改变,更多的产物形成(c)。如果酶2的浓度相对于(b)增加,反应加速,但平衡不改变(d)。图例:S1(蓝色虚线);P1(蓝色实线);NAD 初始浓度(红点、灰线);NAD (红色实线)和NADH(红色虚线)的平衡浓度。
更重要的是,涉及辅酶的反应强烈地受到反应平衡的影响。例如,如图4a所示,氧化还原酶催化一个可逆反应。反应通常在初始阶段进行得很快,最终达到一个平衡状态,正反反应速率和物质浓度保持不变。辅酶再生的第二种酶的引入使得推动主反应趋向一个新的平衡态成为可能,导致反应物转化率升高(如图4b所示,实验示例见文献35)。在耦合反应中,任何时间点都满足物质平衡:[NADH] = [P1]minus;[P2]。这表明辅酶浓度依赖两种酶的耦合动力学,并有非单调的、复杂的时间响应性。然而,当底物1的转化达到平衡时,它们的平衡浓度是唯一且确定的。增加底物2的浓度是一种有希望实现更高主反应转化率的方法(图4c)。而增加酶2的浓度只能加快初始相的反应速度,不能改变平衡态(图4d)。Braun等人在12alpha;-羟基类固醇脱氢酶耦合用于辅酶再生的乙醇脱氢酶催化氧化胆酸的研究中很好的阐述了这些结论[36]。许多研究人员像测定单酶一样通过测量辅酶浓度的变化来进行辅酶再生级联的活性测定。但是,这种变化并不直接表明底物的转换(图4b-d),因此任何基于测定辅酶浓度的结论都是不可靠的。与顺序级联相似,较短的瞬态时间或较快的初始反应速率并不能证明存在通道作用(图4 c, d)。此外,在研究这类耦合反应时必须考虑平衡态。在实际应用中,为了避免平衡限制,准不可逆酶反应是辅酶再生的首选方法。例如,工业应用中最常用的一种酶是甲酸脱氢酶,因为在NAD(P)H的再生过程中,它催化甲酸氧化为CO2,而CO2易从体系中去除[37]。
2.3.支架对级联活性的影响
从2002年第一个DNA支架双酶的例子开始,在许多研究中,当酶锚定在DNA纳米结构上时,可以观察到酶级联活性的增强[38]。复杂的DNA折纸结构经常被报道被设计用来操纵各种酶的位置、化学计量和空间分布,并且整体活性的增强[1-3,39,40]。正如我们上面所讨论的,顺序反应的最终活性受到限速酶的限制,辅酶偶联反应的最终转化受到平衡的限制;因此,任何由于便利运输而引起的活性增加都必定是短暂的。然而,大量的前期研究显示,级联活性似乎被永久地增强了。这里我们将详细回顾这些实验,并试图解决理论分析和实验观察之间的矛盾。
一个常用的顺序酶模型对是葡萄糖氧化酶(GOx)和辣根过氧化物酶(HRP)。Wilner等人在二维六边形结构上协同组装GOx和HRP酶,并观察到与溶液中没有
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[257494],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 选择性能量转移催化烯烃的含硼几何异构化外文翻译资料
- 瑞德西韦阻滞SARS-CoV-2聚合酶的作用机理外文翻译资料
- 铱催化的共轭二烯的C-H烯基的烯丙基化反应外文翻译资料
- 铱和布朗斯特酸协同催化烯丙醇对萘酚衍生物的对映选择性脱芳构化外文翻译资料
- 新型选择性MT2受体配体2-(苯硫基)苯并[b]噻吩类化合物的制备和药理学评价外文翻译资料
- Ilimaquinone是一种海绵代谢产物,通过gadd153介导的途径发挥抗癌作用外文翻译资料
- 用环境敏感药物释放的三氧化二砷靶向介孔二氧 化硅纳米颗粒有效治疗三阴性乳腺癌外文翻译资料
- 复方中草药对雄性荷斯坦犊牛生长表现,胴体特征和肉质的 影响外文翻译资料
- 线粒体在没有人体ATP合酶的亚基c时渗透性转 变的持久性外文翻译资料
- 基于呋喃类化合物构建环氧树脂 2,5-呋喃羧酸(FDCA)生物基环氧树脂的合成及性能研究外文翻译资料


