
英语原文共 4 页,剩余内容已隐藏,支付完成后下载完整资料
有机染料二聚体修饰的金纳米粒子用于比率pH测量
摘要:有机染料与非发光金属纳米粒子结合产生的协同效应大大拓宽了它们在成像和传感方面的应用。在此,我们报道了一种众所周知的对pH不敏感的染料(四甲基罗丹明),与对pH不敏感的发光金纳米粒子结合,可以制成比率式荧光显示局部pH的超微纳米指示剂。这种协同作用源自于四甲基罗丹明在金纳米粒子上的二聚作用,且其几何结构对金纳米颗粒的表面电荷非常敏感,可以通过周围谷胱甘肽配体的质子化作用来相对调节。同时,不仅限于对pH不敏感的染料,这种取决于pH的二聚作用还能增强一种知名度高的pH敏感染料即荧光素在更大pH响应范围的pH敏感性,从而开拓了设计可调波长以及pH响应范围的超微荧光比率式纳米指示剂的新道路。
金属纳米粒子通常是不发光的,这是由于它们较大的态密度。因此,将有机染料结合到非发光金属纳米粒子上,是使得它们在荧光成像系统中可视化的必要条件。例如,Chan et al.将有机染料Cyto633与不同尺寸的非发光金纳米粒子结合,从而可以在活体内实时监测到这些金纳米粒子。此外,这种简单的方法也产生了许多协同效应,可以进一步扩大有机染料和金属纳米粒子的成像和传感方面的应用。比如,用有机染料分子标记的巨型拉曼散射已被用于多光谱癌症成像。通过利用金纳米粒子的荧光猝灭效应,染料-金纳米粒子的复合物可以作为检测单链DNA、蛋白质和小毒素的传感器。
与传统的非发光金属纳米粒子相比,在过去的十年中,人们发现了一种新的金属纳米粒子,可以在没有被有机染料标记的情况下,发出本征荧光。通过调整粒度,结晶度,表面配体以及价态,我们以及其他研究者可以制备出大量有着从紫外区到近红外区的可调激发范围的发光金属纳米粒子。与染料标记的非发光金属纳米粒子互补,有着本征激发的金属纳米粒子,在成像和传感方面也有很多应用。例如,红光金纳米粒子已经用来检测小的金属离子,毒素,以及活性氧。更多最近的研究显示,近红外发射的金纳米粒子可以作为新型肾脏可清除造影剂用于快速肿瘤诊断和肾脏功能成像。尽管这些发光金属纳米粒子的出现表明,在荧光成像系统中,检测金属纳米粒子时有机染料可能不再被需要了,然而有机染料与发光金纳米粒子的结合是否可以产生新的协同作用使得整个过程既非有机染料控制也非发光金纳米粒子控制仍然是相当未知的,并且从未被广泛地探讨过。
在此,我们报道了一种通过将对pH不敏感的染料,581nm发射的四甲基罗丹明(支持信息,图S1),与近红外激发的由谷胱甘肽配体包裹的对pH不敏感的金纳米粒子结合制成的比率式pH传感器。当pH从6增大到10的时候,四甲基罗丹明的发射强度增大了超过5倍,而谷胱甘肽修饰的金纳米粒子的发射强度仅仅改变了不到10%。因此,四甲基罗丹明与谷胱甘肽修饰的金纳米粒子的发射比率成线性关系取决与局部环境的pH。光物理光谱研究表明,它的这种取决于pH的发射性质来自于其在金纳米粒子上的二聚作用,其几何结构对在金纳米粒子上的谷胱甘肽配体的质子化作用非常敏感。不局限于不敏感的染料,一种众所周知的pH敏感染料,荧光素,在与谷胱甘肽配体修饰的金纳米粒子结合后,在更大的pH值范围内变得更加敏感了。这些结果清楚地表明,这种由有机染料结合到发光的金纳米粒子上的独特的增强效应,提供了一种设计超小比率式pH响应的纳米指示剂的途径。
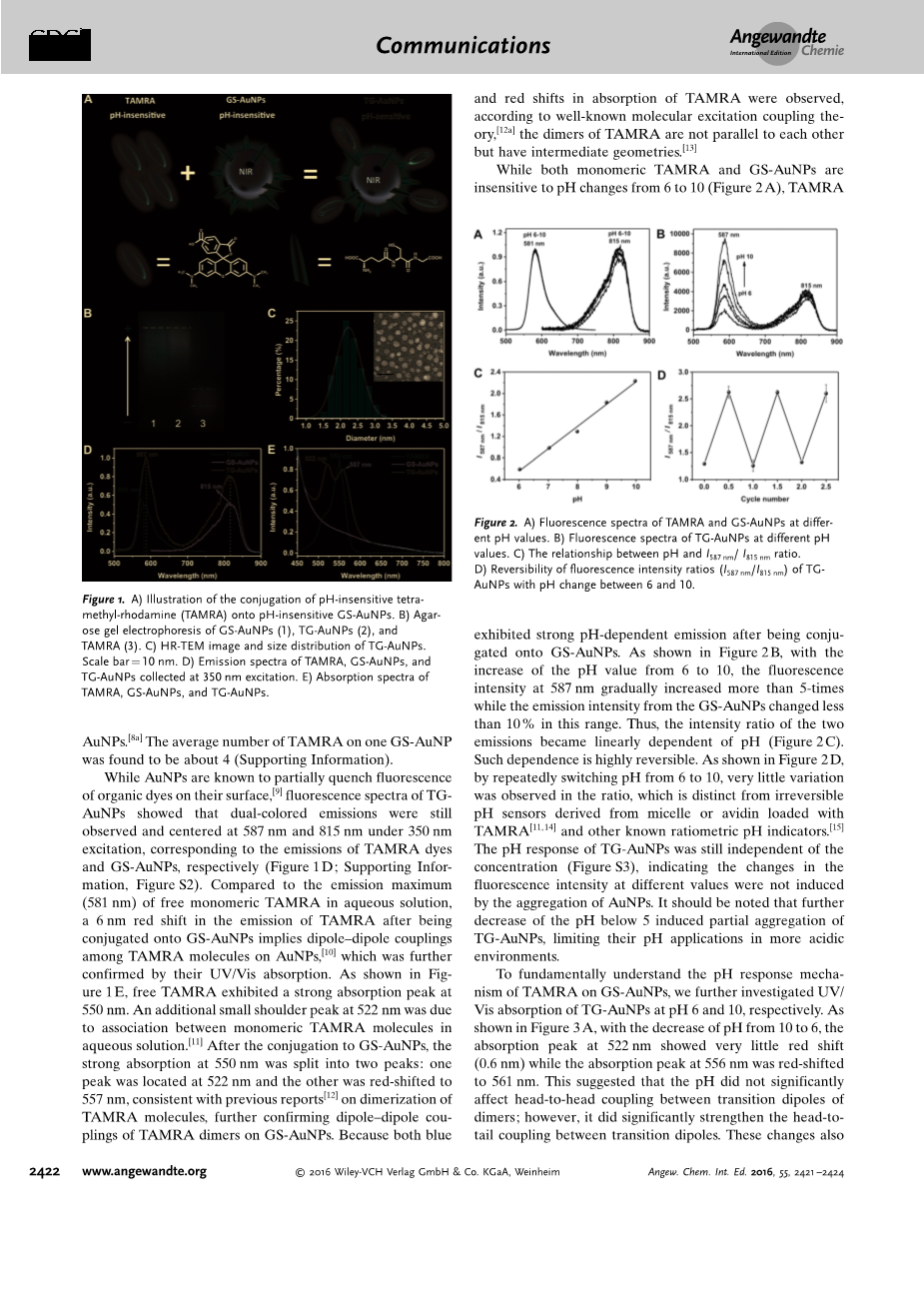
四甲基罗丹明与谷胱甘肽配体修饰的金纳米粒子的结合合成非常的直截了当。我们用之前报道过的方法合成了815nm发射的谷胱甘肽配体修饰的金纳米粒子,然后在全暗环境室温下将四甲基罗丹明(1.6mu;M)与这些金纳米粒子(0.4nM)在磷酸盐缓冲溶液中混合反应。24小时后,用葡聚糖凝胶柱将未反应的粉色四甲基罗丹明溶液除去,并且收集微红的溶液。用琼脂糖凝胶电泳首次证实了四甲基罗丹明与谷胱甘肽配体修饰的金纳米粒子的结合。如图1B所示,微黄色的谷胱甘肽配体修饰的金纳米粒子与自由的淡粉色四甲基罗丹明有着不同的迁移率,而淡红色的四甲基罗丹明-谷胱甘肽-金纳米粒子有着与谷胱甘肽配体修饰的金纳米粒子相似的迁移率。高分辨率透射电子显微镜显示四甲基罗丹明-谷胱甘肽-金纳米粒子的平均粒径为2.2士0.4 nm(图1C),与谷胱甘肽配体修饰的金纳米粒子的核心尺寸一致,在一个谷胱甘肽配体修饰的金纳米粒子上发现的四甲基罗丹明的平均个数为4(支持信息)。
尽管我们知道金纳米粒子会部分猝灭它们表面上有机染料的荧光,但四甲基罗丹明-谷胱甘肽-金纳米粒子的荧光光谱表明,在350nm的激发波长下,这种双色的发射波长仍然集中在587nm和815nm,这分别与四甲基罗丹明和谷胱甘肽配体修饰的金纳米粒子的发射波长相对应。与溶液中的自由单体形式的四甲基罗丹明的最大发射波长(581nm)相比,它与谷胱甘肽配体修饰的金纳米粒子结合后,发射波长产生了6nm的红移,这意味着在四甲基罗丹明和金纳米粒子之间发生了取向耦合,进一步证实了它们的紫外可见光吸收。如同图1E所示,在550nm处,自由四甲基罗丹明染料有一个很强的吸收峰。在522 nm处有一个额外的小肩峰,是由于在水溶液中单体TAMRA分子间的联合。在与谷胱甘肽配体修饰的金纳米粒子结合后,这个550nm处的强吸收峰分裂成了两个:其中一个位于522nm处,另一个则红移至557nm,这与之前报告的四甲基罗丹明的二聚作用一致,进一步证实了四甲基罗丹明二聚物与谷胱甘肽配体修饰的金纳米粒子之间的取向耦合作用。由于四甲基罗丹明吸收波长的蓝移和红移都能被观察到,根据著名的分子激发耦合理论,其二聚体不是相互平行的,而是具有中间的几何形状。
尽管单体四甲基罗丹明染料和谷胱甘肽修饰的金纳米粒子都对6-到10的pH范围不敏感,但是当四甲基罗丹明与金纳米粒子结合后却表现出强烈的pH决定性发射。如图2B所示,随着pH从6到10不断升高,587 nm处的荧光强度逐渐增加到了5倍以上,而谷胱甘肽修饰的金纳米粒子的发射强度在此范围内变化不到10%。因此,两种发射强度比与pH值成线性关系(图2C),这种决定性是高度可逆的。如图2D所示,通过反复改变从6到10的pH值,这个比率仅仅发生了很小的改变,这与由胶束或亲和素和四甲基罗丹明或其他已知的比率式指示剂制备的不可逆pH传感器不同,四甲基罗丹明-谷胱甘肽-金纳米粒子的pH响应仍然与浓度无关(图S3),表明不同数值的荧光强度变化不是由金纳米粒子的聚合引起的。需要注意的是,pH的进一步降低会导致四甲基罗丹明-谷胱甘肽-金纳米粒子的部分聚集,从而限制了其在酸性环境下的p H方面应用。
为了从根本上了解二甲基罗丹明在谷胱甘肽配体修饰的金纳米粒子上的pH响应机制,我们进一步研究了二甲基罗丹明-谷胱甘肽-金纳米粒子在pH 6和10的紫外可见光吸收。如图3A所示,随着pH从10降到6,在522 nm处的吸收峰显示出非常小的红移(0.6 nm),而在556 nm处的吸收峰为红移至561 nm。这表明,p H并没有显著影响调光剂的过渡偶极之间的头对头耦合,然而,它明显加强了过渡偶极之间的头尾耦合。这些变化也暗示了两个过渡偶极之间的夹角变大了,而且随着pH值的增加,耦合也变弱了。因此,二甲基罗丹明调光剂的能量转换效率变低了,而其发射强度显著增加了。另一方面,810nm的谷胱甘肽修饰的金纳米粒子的810nm发射表现出非常小的p H响应(lt; 10%),类似于纯谷胱甘肽-金纳米粒子,这意味着二甲基罗丹明和谷胱甘肽-金纳米粒子之间的荧光共振能量转移很小。这个结果与我们的荧光寿命测量结果一致。纯谷胱甘肽-金纳米粒子810nm处发射的平均寿命为1.39 plusmn;0.08 ms,几乎与二甲基罗丹明-谷胱甘肽-金纳米粒子(1.19 plusmn; 0.05 ms)的完全相同,这表明在二甲基罗丹明与谷胱甘肽配体修饰的金纳米粒子之间没有荧光能量转移。
为了进一步了解p H对谷胱甘肽配体修饰的金纳米粒子上二甲基罗丹明的二聚作用的影响,我们测量了二甲基罗丹明-谷胱甘肽-金纳米粒子在pH10和6的zeta电势。如图3B所示,随着p H从10减小到6,二甲基罗丹明-谷胱甘肽-金纳米粒子的整体zeta电势减小了20 m V(从- 39.8 m V到- 11.8 m V),几乎与纯谷胱甘肽-金纳米粒子的zeta势能变化(从- 29.4 m V到- 9.5 m V)一致。这使得zeta电位的降低被归因于谷胱甘肽修饰的金纳米粒子的胺组的质子化,而不是二甲基罗丹明,因为二甲基罗丹明-谷胱甘肽-金纳米粒子和纯谷胱甘肽修饰的金纳米粒子显示了几乎相同的趋势。我们对二甲基罗丹明-谷胱甘肽-金纳米粒子在不同p H条件下的zeta电位进行了更详细的研究,结果表明,由于谷胱甘肽(图S5)的保护,p H的降低导致了二甲基罗丹明-谷胱甘肽-金纳米粒子的整体表面电荷逐渐减少。根据观察,这种由于金纳米粒子上固定的谷胱甘肽配体胺基质子化作用所导致的表面电荷的减少与最近所报道的这些配体在纳米粒子表面固定后pKa发生改变是相符的。结合二甲基罗丹明-谷胱甘肽-金纳米粒子在不同p H环境下的紫外可见光吸收、荧光和zeta电势,提出了一种假设机制,如图3 C所示: 随着p H从6到10的增加,在谷胱甘肽-金纳米粒子上的二甲基罗丹明调光剂的过渡偶极间的夹角略有增加,并且由于在金纳米粒子上带负电荷的谷胱甘肽配体的斥力增加,使得二甲基罗丹明二聚体之间的耦合减少。因此,随着p H的增加,二甲基罗丹明的荧光强度会显著增加。
为了证明我们所观察到的pH决定性二聚作用能否应用于pH敏感染料,我们将5(6)-羧基荧光素(图S6),一种众所周知的pH敏感型染料,用同样的方法结合到谷胱甘肽修饰的金纳米粒子上(支持信息)。这种与荧光素结合的谷胱甘肽-金纳米粒子的平均尺寸为2.2 plusmn;0.5 nm(图4A),与二甲基罗丹明-谷胱甘肽-金纳米粒子相似。在减去谷胱甘肽-金纳米粒子吸收后,我们可以观察到荧光素-谷胱甘肽-金纳米粒子在445nm处有一个新的峰,与游离荧光素的最大吸收峰相比,有一个47nm的蓝移(图4B),与此前荧光素的H-二聚作用的报道(40nm)一致。
在荧光素-谷胱甘肽-金纳米粒子上可以观察到更加敏感的pH决定性发射。当p H从5增加到11时,Au NPs在470 nm激发波长下的525 nm处发射强度增加了约19倍(图4 C),在相同pH条件下,其敏感性几乎是游离荧光素的四倍。此外,不像游离荧光素仅仅对对pH值5到7(图S7)范围内的变化作出反应,荧光素在金纳米粒子上的释放一直保持pH响应,直到pH达到11。更有趣的是,在与荧光素结合后,金纳米粒子的815nm发射(在350 nm激发波长下;图S8)对pH变化敏感: 当p H从5增加到11时,815 nm的发射强度增加了大约3.5倍。二甲基罗丹明-谷胱甘肽-金纳米粒子和荧光素-谷胱甘肽-金纳米粒子之间的差异很可能是由于荧光素发射和谷胱甘肽-金纳米粒子激发之间效率更高的能量传递,从而产生较大的光谱重叠(超过47%;图S9)。为了进一步证实荧光素和谷胱甘肽-金纳米粒子之间的能量传递,我们还测量了从谷胱甘肽-金纳米粒子与荧光素结合前后的810nm发射波长的寿命,发现810nm的寿命从1.39plusmn;0.08 ms 减少到了 0.81plusmn;0.05 ms(图S4),进一步确认荧光素与谷胱甘肽-金纳米粒子之间的能量传递。此外,这种荧光素-谷胱甘肽-金纳米粒子同样以比率式方式报告pH。(图S11)
综上所述,有机染料与超小型发光金纳米粒子的结合可以导致一种独特的增强效果,即使得pH不敏感的染料呈现出pH决定性发射,而pH敏感型染料则会在一个更大的pH范围内对pH的变化更加敏感。因此,有机染料与金纳米粒子的发射比可以用来定量反应局部pH的变化。这种有趣的pH响应源于极小型金纳米离子表面上有机染料的二聚作用,其几何结构对于表面电荷的改变非常敏感并且可以通过金纳米粒子表面配体的质子化作用来调整。需要注意的是,这种pH决定性发射仅仅限于极小金纳米粒子,因为在7nm的二甲基罗丹明-谷胱甘肽-金纳米粒子表面,尽管我们依旧可以观察到二甲基罗丹明的发射,但是不再能够观察到相似的pH决定性发射(图S12)。然而,这种协同效应是由有机染料的简单结合到超小发光的金纳米粒子表面上产生的,并开辟了新的途径来设计可调节发射波长和广泛的pH响应范围的荧光比率式纳米指示剂。
支持信息
材料与器材
所有的化学药品都是从Fisher科技公司购买的,未经进一步的净化就被使用。利用加速电压为2kv的JEOL 2100透射电子显微镜获得了RG-金纳米粒子的透射电子显微镜图像。利用Brookhaven 90Plus动态光散射(DLS)粒度分析仪,分析了水溶液中样品的水动力直径(HDs)。该样本的Zeta电位由Brookhaven Zeta电位分析仪分析。用PTI时间分辨荧光寿命谱仪测定荧光寿命。用Accumet AB15 pH计和Accuphast微探针测量了pH。吸收光谱采用瓦里安50生物紫外分光光度计。用一种基于荧光的多模微板阅读器测定了不同浓度RG-金纳米粒子的荧光强度。
合成与表征
二甲基罗丹明-谷胱甘肽-金纳米粒子的合成,在小瓶磷酸盐缓冲溶液 (PBS)中,NHS-二甲基罗丹明-二甲基亚砜溶液(80micro;L 20 m M)被添加到谷胱甘肽-金纳米粒子上 (200micro;L ,2micro;M ,p H ~ 8)。在室温下,混合物在室温下被搅拌了24小时,而二甲基罗丹明的NHS 脂则与谷胱甘肽的胺反应,形成了稳定的酰胺键。在反应完成后,混合物通过葡聚糖凝胶柱,去除未反应的二甲基罗丹明分子。收集了第一个洗脱期。
荧光素-谷胱甘肽-金纳米粒子的合成
荧光素二甲基亚砜溶液((400mu; L, 4.5 m M))被加入到在磷酸盐缓冲溶液中的谷胱甘肽-金纳米粒子中(200 micro;L, 2 micro;M, p H~8)),混合物在黑暗环境下室温搅拌24小时。反应完成后,该混合物在21,000 g离心2分钟。沉淀在PBS中再溶解并收集。最后通过葡聚糖凝胶柱,去除未反应的荧光素分子。收集了第一个洗脱期。
量化每个纳米粒子上的二甲基罗丹明数
全文共6142字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[8717],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 复杂热电材料外文翻译资料
- 以自蔓延高温烧结方法制备热电化合物以及燃烧合成的新标准外文翻译资料
- 氮掺杂分级多孔碳作为氧还原反应的高效电化学催化剂的研究外文翻译资料
- 孪晶诱导塑性高嫡合金的设计外文翻译资料
- 含铌先进Fe-Cr-Ni型奥氏体耐热钢富铜相的析出强化在超临界电厂的应用外文翻译资料
- 不同温度下直接能量沉积层状工具钢的弯曲强度外文翻译资料
- BiFeO3的光伏效应外文翻译资料
- 通过氢稳定的MgaPt研究核壳纳米结构Mg@Pt中快速“氢泵”的可视化外文翻译资料
- 一种铱核心环金属有机配体显著地提高了有机太阳能电池 的光伏性能外文翻译资料
- 钠离子电池的高性能阳极材料:三组分共组装法制备层次多孔碳外文翻译资料


