
英语原文共 11 页,剩余内容已隐藏,支付完成后下载完整资料
锂空气电池机理的研究进展
Doron Aurbach,Bryan D. McCloskey,Linda F. Nazar and Peter G. Bruce
可充电锂空气电池在所有可充放电池中具有最高的理论比能量,如果可以制造出实际器件将使储能器件得到巨大改革。在基本原理的层面上,我们对电池中发生的反应和过程知之甚少,这将是研究进展上的一个巨大的障碍。因此我们对锂空气电池机理特别是正极反应的研究进展做了最新的调研,对放电过程中O2还原成Li2O2和它的逆反应过程进行细致的讨论,也会考虑到它们的的充放电倍率和容量,同时还会对在充放电时涉及到正极和电解质的各种寄生反应进行考虑。最后,为了做出更好的锂空气电池我们会总结出关于正极、电解液的稳定性及检查设计的原则。
如果要显著减少CO2的排放,我们需要对现有储能技术有所突破。锂离子电池已经是一个巨大的成功,并且在未来几年还将继续改善进步。但是,如果我们有任何希望做出新型的储能器件来满足未来对能源的需求,就不会局限于锂离子电池,而是研究能替代甚至超越锂离子电池的技术。
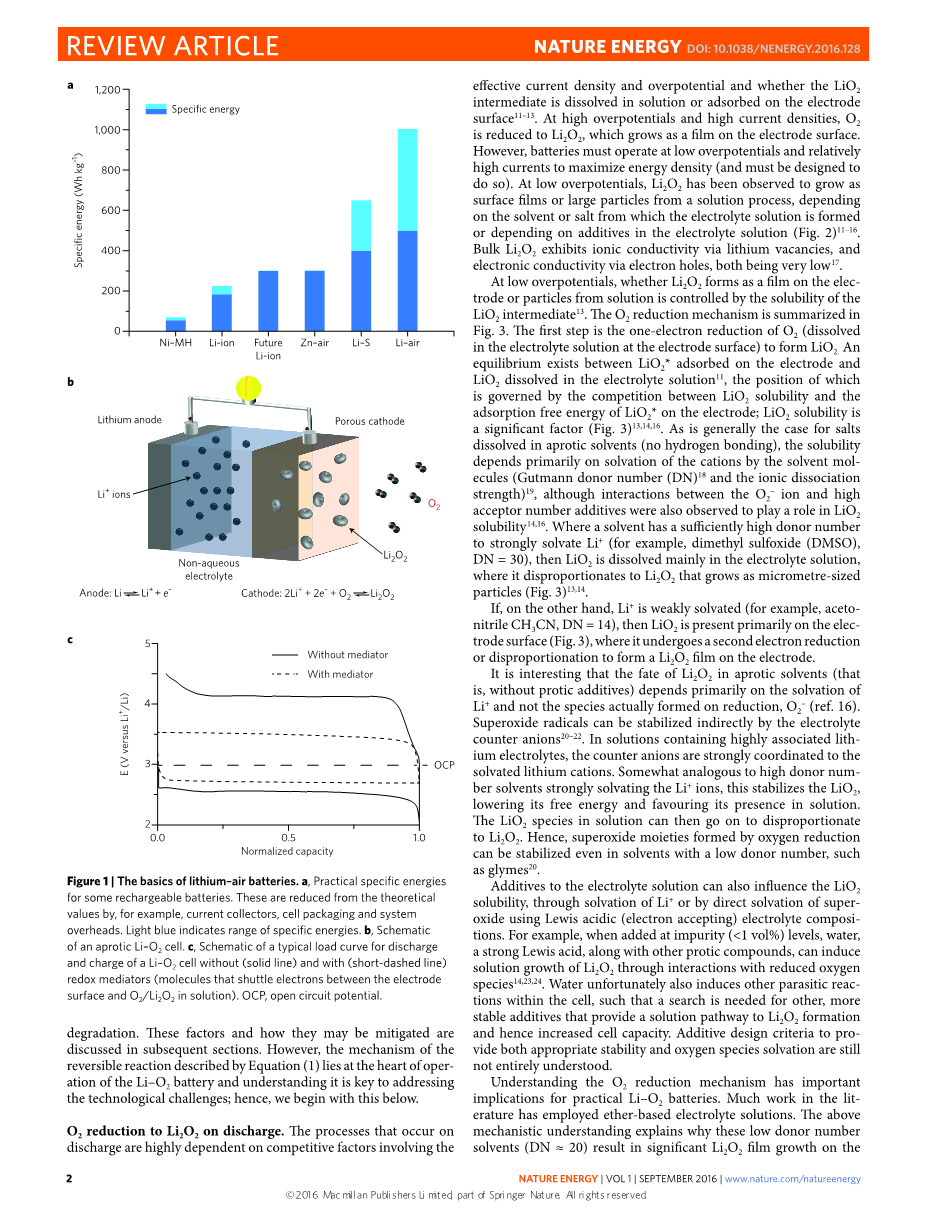
Li-air电池使用的氧气来自空气,最高的理论能量是3500Wh/kg。但实际的能量是不确定的,存在许多未知因素,但实际值也在500-1000Wh/kg,足以为电池电动汽车提供超过500公里的能量(见图1a)。氧气作为正极燃料是完全免费的,图1b是非质子Li-air电池的示意图。虽然Li-air电池的储能优势比其他充电电池高,但是我们依旧缺乏对其基础化学及电化学的研究。Li-air电池结合了两种具有挑战性的电极,金属和空气。金属锂电极已经研究多年,但是仍然不能提供必需的循环效率,相关的研究也受到抑制。但是Li负极保护已经有了前景——在固体电解质中插入Li金属并注入液体电解质——这为高能量功能锂空气电池的探索提供了一个重要的路径。相比之下,非质子的Li-air的探索刚开始,只有少数论文讨论了O2在相关电解质中还原的解决方案,对O2/Li2O2在非质子溶剂中的氧化还原高度重视。除了O2 / Li2O2氧化还原电对,非质子Li-O2还面临其他挑战,尤其是电解质溶液和正极面对还原氧的稳定性。如果我们要实现一个实用的电池项目,所有的这些过程都需要理解和掌握。即便如此,空气的处理和过滤问题也需要通过新的化学工程方案去解决。尽管如此,只有通过对Li-air电池的科学与工程更深入的理解,我们才能将它实际应用起来,证实它是一个可行的技术。
在本文中,我们关注的是在过去几年里最新的研究进展,包括氧气在正极放电时还原成Li2O2和Li2O2在充电时被氧化的机理以及电解液和正极降解的机理。与所有这些潜在的改变现有理论的想法一样,开始抱有期望,其次是不可避免的幻灭,此后才往往是平衡的建立,如今Li-O2正处于第三阶段。现在在理解基础科学支撑Li-air的研究上有真正的进展,先前的工作结果让我们相信Li-O2将不可避免地成为一个低利率、低容量、高极化的电池,而新的工作在基础科学层面上揭示结果不一定是这样。没有人知道Li-O2是否会成为一门真正的技术,但是我们有责任对社会和我们的未来探索一切可能的东西。
非质子O2电极的机理
不同于燃料电池中O2反应产生H2O,在Li-O2电池中O2反应产生的是绝缘固体Li2O2,这对电池的运作具有深远的影响。
图1c是一个典型的Li-O2的充放电循环图。Li的动力学负极相对简单,因此在图1 c的放电和充电(过电压)中热力学势(开路电位)的差异主要由正极反应决定。理想的正极反应方程如图所示(1)
许多因素可以影响过电压,如电解液的副反应产品沉积以及电极的降解。这些因素以及如何缓解它们将在随后的章节中讨论。然而,方程(1)描述的可逆反应的机理才是运行Li-O2电池的核心,理解它是应对技术挑战的关键。下面我们就来开始讲解这些东西。
图1 |锂空气电池的基础知识。a.充电电池的实际能量。相比于理论值减少了,例如受集流体、电池装置和系统消耗等影响。浅蓝色区域表示比能量的范围。b.一个非质子Li-O2电池示意图。c.有无中介物质(实线无,虚线有)的典型负载曲线。
O2还原成Li2O2的放电过程。这个放电过程很大程度上取决于一些竞争因子,包括有效电流密度、过电压和LiO2中间产物是否溶于溶液或者吸附于电极表面。在高过电压和高电流密度下,O2被还原成的Li2O2附着于电极表面。然而,电池必须运行在低过电压和相对较高的电流才能使能量密度最大化(而且必须这么设计)。在低的过电势下,我们观察到Li2O2生长成膜或者从溶液中析出生成大型颗粒,这些都取决于溶剂或电解液中形成的盐电解质或者取决于电解液中的添加剂(图2)。大部分Li2O2通过锂离子空缺展示出离子导电率和通过电子空穴展现出的电子电导率都是非常低的。
在低的过电势下,Li2O2是以电极的薄层形式还是从溶液析出的粒子形式形成是由中间产物LiO2的溶解度所决定。图3概括了O2的还原机理。第一步是O2(溶于电解质电极表面附近的O2)单电子还原成LiO2。之间存在一个LiO2 吸附在电极和LiO2溶解在电解质溶液的平衡,这取决于LiO2的溶解度和LiO2在电极上吸附的自由能的竞争结果。LiO2溶解度是一个重要因素(图3)。盐溶解在非质子溶剂(无氢键)中的一般情况下,溶解度主要取决于溶剂分子的阳离子的溶解作用(古特曼施主数(DN)和离子的解离能力),尽管O2-离子和高数量受体添加剂的相互作用也会影响到LiO2的溶解能力。当溶剂有足够高的施主数去强有力地结合Li (例如,二甲亚砜(DMSO),DN = 30),那么LiO2就主要溶解在电解质溶液中,然后发生歧化生成微米级别的Li2O2颗粒(图3)。
另一方面,如果Li 是弱溶剂化物(例如,乙腈CH3CN DN = 14),那么LiO2主要存在于电极表面(图3),在那里经历了第二个电子还原或歧化在电极上形成Li2O2膜。
有趣的是,Li2O2在非质子溶液的形成主要取决于Li 的溶解度而不是实际的还原产物O2-(参考文献16)。超氧化物自由基可以间接地通过电解液中的共存阴离子稳定。在包含与锂高度相关的电解液中,共存阴离子会与溶解的锂阳离子强烈地调和。这样稳定LiO2,降低其自由能,有利于它存在溶液中的方式有点类似于高施主数强烈地使Li 溶剂化。溶液中的LiO2可以不按比例地转化成Li2O2。因此被氧气氧化的部分超氧化物甚至可以在低施主数的溶剂中稳定,例如聚乙烯醚类。
电解质溶液的添加剂也可以影响LiO2的溶解度,通过溶解Li 或直接溶解使用路易斯酸(电子接受)电解质成分的过氧化物。例如,当添加杂质(lt; 1%)的水平,水作为一个强的路易斯酸连同其他质子化合物,可以通过与氧气的相互作用诱导Li2O2的液相生长。不幸的是,水在电池中也会诱导寄生反应,以至于我们需要探索一个其他加稳定的添加剂来解决Li2O2的形成来增加电池容量。添加剂设计标准是能提供适当的稳定性和氧化物溶解,这些仍然没有被完全掌握。
理解O2还原机理对实际的Li-O2电池有重要意义。很多工作在文献中已经使用乙醚基电解质溶液。上述机理解释了为什么这些低施主数溶剂(DNasymp;20)导致电极上Li2O2薄膜的严重生长。这种绝缘薄膜可以生长到6 - 7nm,导致电极钝化,以至于低电容,低倍率和电池的过早衰竭。相比之下,电解质溶液溶解LiO2可以最小化这种表面膜生长,可以提高倍率,容量和持续放电能力。有关Li-O2的多孔正极设计的改变思考,让其远离高表面积在具有多孔的电极上储存从溶液中生长出的Li2O2颗粒。使用这类电极的Li-O2电池,与那些在电极表面附着LiO2薄膜的电池相比,可以提供相对较高的比能量(重量分析)和能量密度(体积分析)(参考文献13)。
中间产物LiO2是个不利条件,尤其是在其可溶性形式。它具有很强的活性,尤其是对那些具有高施主数的溶剂可以溶解LiO2,它对于一些电极材料也具有活性,甚至在没有大量传输限制的时候,还能使电池的放电电位值略低于开路电位。最近,有一种可以促使O2还原成Li2O2的方法,可以避免LiO2的生成和它的不利因素,例如在电解质溶液中添加2,5-二叔丁基-1,4-苯醌(DBBQ)。在放电时,DBBQ首先会在正极还原成DBBQ-,然后结合Li ,将O2还原成O2-,这个过程会在溶液中形成复杂的LiDBBQO2,最后歧化产生Li2O2和新的DBBQ,就这样循环来维持放电。举个例子,通过避免LiO2生成和相对稳定的不溶解LiO2的电解质溶液,在二甲氧基乙烷(DME)中加双三氟甲烷磺酸亚胺锂(LiTFSI),相比在DME中没有DBBQ的情况,仍然可以使溶液中形成Li2O2,有更高的放电倍率和更高的电池容量(一般有80倍)(图4)。新的中间产物LiDBBQO2相比于LiO2更稳定(更低的自由能),因此可以降低放电时的过电压(图1c)。避免LiO2溶于溶剂反应的另一个好处就是可以减少副反应,这点可以从高产的Li2O2可以看出(掺DBBQ的DME与没有掺的相比,Li2O2的产出比是95%:87%)。这种还原机制可能不同于先前的研究的分子梭,通过在比直接还原更低的电位上转移外层电子还原O2,例如紫罗碱,或者那些反应前后结合O2的分子,例如酞菁染料。
最近,其他不同的产品的放电机理经常被报道。Lu等人认为可能可以通过吸附在铱基电极上来稳定LiO2,这就使其变成了反应的产物而不是一个中间产物。据报道,这种电池显示出比O2 / Li2O2反应更好的可逆性。应该注意的是,工作会继续在水系Li-O2上开展而且与Zn-O2密切相关。Li-O2非质子电池的美好前景在正极涉及的LiOH的反应最近也被提出,尽管其机理仍然不是很清楚。
图2 |在不同的电解质溶液中Li2O2的表面和溶液生长机理。最后一步Li2O2的形成可以是化学反应(歧化)或电化学反应(第二步还原)。ACN glymes,DMA和DMSO溶剂分别是乙腈、聚醚(CH3O(CH2CH2O)nCH3),二甲基乙酰胺和二甲亚砜。TFSIminus;和Tf-分别是阴离子双(三氟甲烷磺酰胺)和三氟甲磺酸酯。参考17下的定义,施主数为溶剂一定的亲核性。参考18中的解释,负电荷的离域、给定阴离子的大小和空间效应决定盐的离子聚合强度。
图3 | Li-O2电池在低的过电压还原机理。LiO<sub
剩余内容已隐藏,支付完成后下载完整资料</sub
资料编号:[136664],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 复杂热电材料外文翻译资料
- 以自蔓延高温烧结方法制备热电化合物以及燃烧合成的新标准外文翻译资料
- 氮掺杂分级多孔碳作为氧还原反应的高效电化学催化剂的研究外文翻译资料
- 孪晶诱导塑性高嫡合金的设计外文翻译资料
- 含铌先进Fe-Cr-Ni型奥氏体耐热钢富铜相的析出强化在超临界电厂的应用外文翻译资料
- 不同温度下直接能量沉积层状工具钢的弯曲强度外文翻译资料
- BiFeO3的光伏效应外文翻译资料
- 通过氢稳定的MgaPt研究核壳纳米结构Mg@Pt中快速“氢泵”的可视化外文翻译资料
- 一种铱核心环金属有机配体显著地提高了有机太阳能电池 的光伏性能外文翻译资料
- 钠离子电池的高性能阳极材料:三组分共组装法制备层次多孔碳外文翻译资料


