
英语原文共 5 页
初级苯胺与连续流动的碳酸二甲酯的选择性N-单甲基化
Hyowon Seo,Anne-Catherine Bedard,Willie P. Chen,Robert W. Hicklin,Alexander Alabugin,Timothy F. Jamison *
麻省理工学院化学系,77 Massachusetts Ave.,Cambridge,MA 02139,USA
文章历史:2017年10月18日收到2017年11月21日修订后的表格2017年11月23日接受2017年11月26日在线提供
关键词:苯胺的单甲基化连续流动化学绿色化学,碳酸二甲酯,原位保护 - 去保护
摘要:在1,8-二氮杂双环[5.4.0]十一碳-7-烯存在下,使用碳酸二甲酯作为绿色甲基化剂,在连续流动条件下实现苯胺的选择性N-单甲基化。我们的方法利用了连续流动状态下可用的扩展工艺窗口,在高压下安全地在过热溶剂中诱导单甲基化。我们提出通过原位保护 - 去保护途径实现选择性N-单甲基化,其由几种推定的反应中间体的观察到的反应性支持。稳健且可扩展的方法适用于广泛的伯苯胺底物,包括邻位,间位和对位取代的苯胺,以及富电子和缺电子的苯胺。在我们的优化条件下选择性地合成地西泮的合成前体5-氯-2-(甲氨基)二苯甲酮。
1.简介
N-烷基苯胺是制药和农业化学工业中普遍使用的基序.1特别是,N-甲基苯胺存在于一系列生物活性化合物中,如地西泮,flobetapir,triafamone和溴苯酰胺(图1).2 N-烷基化反应 - 反应是药物和精细化学品合成的常见和必要的转化.3然而,由于仲胺与伯胺相比具有更高的亲核性,原代烷基和芳基胺的选择性单-N-烷基化仍然具有挑战性的转变。 N-甲基苯胺的合成具有特别的挑战性,并且通过与烷基卤化物反应或通过还原胺化将经典的方法用于N-烷基化通常导致形成二级和三级苯胺的混合物.4,5通常,实验室N-甲基苯胺的大规模合成需要多步骤序列,包括加入和去除保护基团或安装和彻底减少o与氨基甲酸酯类相比,主要苯胺的选择性N-单甲基化相关的困难通常以N-甲基苯胺类与其主要苯胺类似物的价格反映出来。对于这种看似简单的功能化,每克价格上涨50到100倍并不罕见。
开发用于初级苯胺的选择性N-单甲基化的稳健和选择性方法将大大简化N-甲基苯胺的合成,并且已报道了几种方法。在工业规模上,初级苯胺的N-单甲基化是通过在高温(200e-500℃)下使用非均相过渡金属催化剂与甲醇在气相中反应来完成的.7初级苯胺的均相N-单甲基化反应也已开发出来,但需要昂贵的配体和过渡金属催化剂
碳酸二甲酯(DMC)是一种廉价的绿色甲基化试剂9,常用于羧酸,芳基乙腈,苯酚,吲哚和苯并咪唑的甲基化.10 DMC已被用于初级选择性N-单甲基化在沸石催化剂存在下的苯胺。然而,这些反应使用溶剂量的DMC并且需要使用高压釜以加热反应超过DMC的沸点(沸点= 90℃)并且适应化学计量的反应中产生的二氧化碳。这些挑战限制了DMC作为原料苯胺的选择性N-单甲基化试剂的广泛应用。
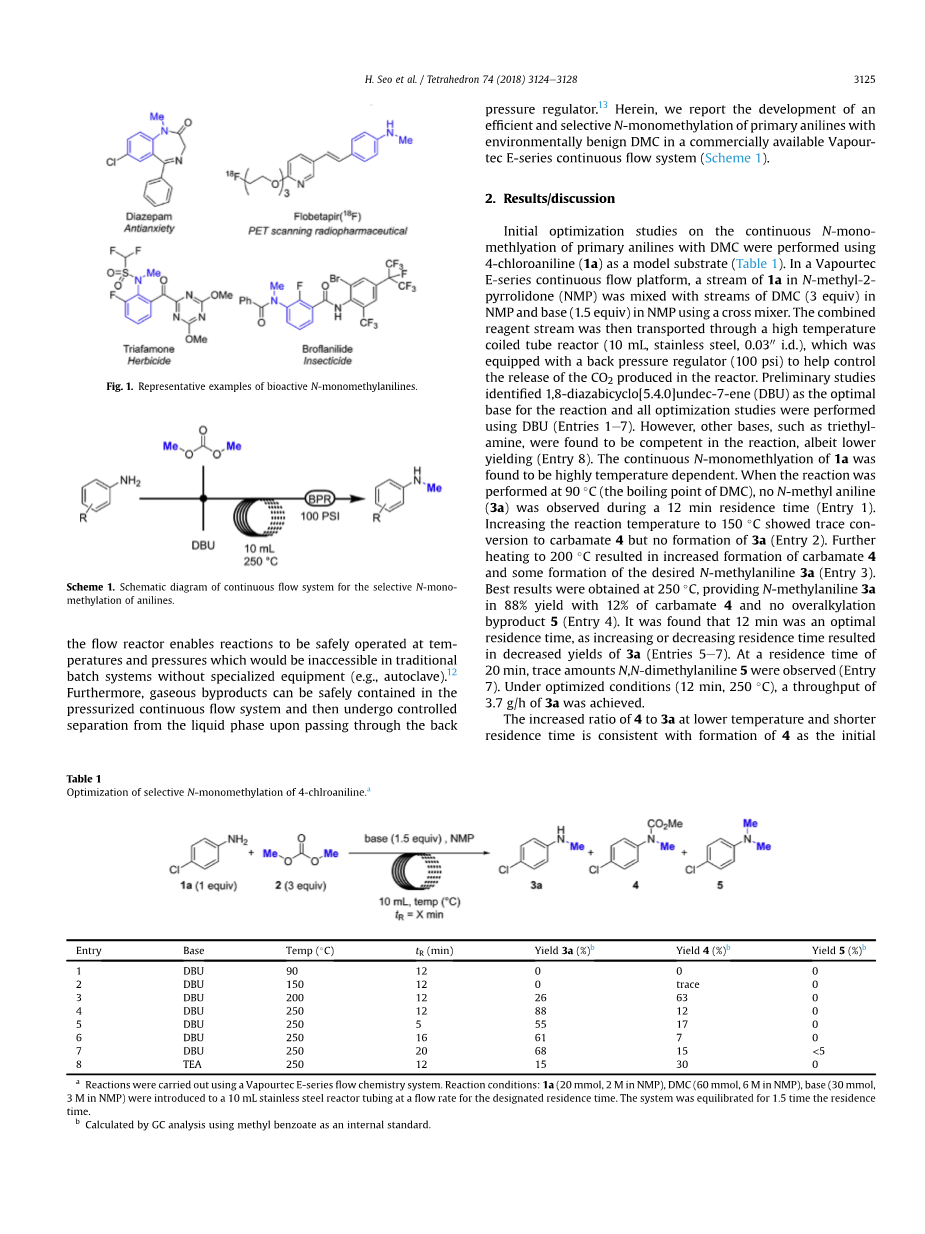
连续流动系统是使用DMC进行苯胺选择性N-单胺化的有吸引力的平台。结合背压调节器(BPR)和少量流动反应器的能力使反应能够在温度和压力下安全运行,而传统的批量系统在没有专门设备(例如高压灭菌器)的情况下无法进行反应.12此外,气态副产物可以安全地包含在加压连续流动系统中,然后在通过背压调节器时从液相中进行受控分离。在此,我们报告了环境友好的有效和选择性的初级苯胺N-单甲基化的发展。 DMC在市售的Vapor-tec E系列连续流动系统中(方案1)。
2.结果/讨论
使用4-氯苯胺(1a)作为模型底物(表1),对用DMC连续进行伯苯胺的N-单 - 甲基化进行初步优化研究。在Vapourtec E系列连续流动平台中,使用交叉混合器将1a在N-甲基-2-吡咯烷酮(NMP)中的流与NMP中的DMC(3当量)和在NMP中的碱(1.5当量)流混合。然后将合并的试剂流输送通过高温盘管反应器(10mL,不锈钢,0.0300 i.d.),其配备有背压调节器(100psi)以帮助控制反应器中产生的CO 2的释放。初步研究确定1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)作为反应的最佳碱基,并且使用DBU(条目1e7)进行所有优化研究。然而,发现其他碱如三乙胺在反应中是有能力的,尽管产率较低(条目8)。发现1a的连续N-单甲基化是高度依赖于温度的。当反应在90℃(DMC的沸点)下进行时,在12分钟的停留时间内没有观察到N-甲基苯胺(3a)(条目1)。将反应温度升至150℃显示出与氨基甲酸酯4的痕量缔合,但没有形成3a(条目2)。进一步加热至200℃导致氨基甲酸酯4的形成增加,并形成所需的N-甲基苯胺3a(条目3)。在250℃下获得最佳结果,提供N-甲基苯胺3a,88%产率,12%氨基甲酸酯4,没有过烷基化副产物5(条目4)。发现12分钟是最佳停留时间,因为增加或减少停留时间导致3a的产率降低(条目5e7)。在20分钟的停留时间,观察到痕量的N,N-二甲基苯胺5(条目7)。在优化的条件下(12分钟,250℃),实现了3.7g / h的3a的通量。在较低温度和较短停留时间下4至3a的比例增加与形成4作为反应的初始产物一致(方案2)。然后可以通过4的原位热脱羧形成N-甲基苯胺3a,类似于无溶剂的热叔丁氧基羰基(Boc)脱保护.14基于这些观察,我们提出反应顺序始于苯胺1a的反应用DMC形成氨基甲酸酯6,然后在DBU存在下通过与第二当量DMC反应使氨基甲酸酯甲基化形成4.然后将氨基甲酸酯4进行热脱羧,得到N-甲基苯胺3a。为了支持这种反应途径,我们发现4分解在250℃形成3a,6与DMC和DBU反应形成3a。这些结果表明,在我们的反应条件下,苯胺优先与DMC反应形成氨基甲酸酯,并且甲基化主要通过DMC与氨基甲酸酯的反应发生。
我们接下来探讨了我们与各种苯胺底物的选择性N-单 - 甲基化反应的范围(表2)。发现取代通常在对 - (3a e 3f),间 - (3g和3h)和邻位(3e e 3l)处耐受。然而,在我们的反应条件下,空间位阻的苯胺如2,5-二甲基苯胺没有经历甲基化。还发现在这些条件下耐受电子缺陷(3a,3b,3i,3k和3l)和富电子(3c,3d,3e,3h和3j)底物。 N-甲基苯胺3l已被用作几种地西泮合成的起始点,但比相应的初级苯胺显着更贵.2a,15在我们优化的连续流动条件下,3l很容易以良好的产率生成而不形成任何过烷基化副产物。
3.结论
总之,使用商业连续流动平台完成了初级苯胺的选择性N-单胺化。该反应使用DMC作为廉价且环境友好的甲基化试剂,并依赖于原位保护/去保护策略以实现优异的单甲基化选择性。连续流动系统可在高温下实现苯胺的安全和稳定的N-单甲基化,产量为3.7克/小时。在反应中通常可以耐受苯胺取代,并且可以用富电子和缺电子的苯胺实现选择性N-单甲基化。该方法成功地用于以低成本以良好的产率合成地西泮的中间产物。
4.实验部分
4.1。一般
使用市售试剂而无需另外纯化。在0.2mm涂覆的硅胶(EM 60 F 254)板上进行分析型薄层色谱(TLC)。用UV光(254nm)和暴露于高锰酸钾溶液然后加热完成可视化。使用Ultra-Sil柱(硅胶,平均粒径25mm球形)在Biotage Isolera闪光色谱系统上进行柱色谱。在Bruker 400MHz NMR仪器(分别为400和101MHz)上获得质子核磁共振(1 H NMR)光谱和碳核磁共振(13 C NMR)光谱。质子的化学位移以四甲基硅烷(d = 0.00ppm)的低磁场百万分率(ppm)报告,并参考CDCl3中的残余prot(7.26ppm)。碳的化学位移以四甲基硅烷的低磁场ppm(d = 0.00ppm)报告,并且参考CDCl3中的残余碳(77.0ppm)。以下描述用于描述多重性:s(单重态),d(双重态),t(三重态),q(四重态),m(多重态),br(宽)。在配备有ATR(衰减全反射)附件的Agilent Cary 630 FT-IR光谱仪上获得IR光谱。以下名称用于描述强度:s(强),m(me-dium),w(弱),br(宽)。高分辨率质谱数据在麻省理工学院化学仪器设备部门的Bruker Daltonics APEXIV 4.7特斯拉FT-ICR质谱仪上获得。气相色谱(GC)在带有火焰离子化检测器的Agilent 5870 GC(HP-5柱)上进行。
4.2。连续流中苯胺选择性N-单甲基化的一般方法
选择性N-单甲缩反应在Vapourtec E系列连续流动系统中进行,该系统配备有高温管式反应器(10mL,不锈钢,0.0300 i.d.,图2)和膜背压调节器(Zaiput)。在烘箱中制备苯胺(20mmol,1.0当量,2M),DMC(5.05mL,60mmol,3.0当量,6M)和DBU(4.47mL,30mmol,1.5当量,3M)的储备溶液 - 使用NMP作为溶剂干燥10mL容量瓶。将溶液转移到具有隔膜帽的螺纹小瓶中,并将试剂直接从小瓶中泵出。在将高温盘管反应器加热至250℃后,使用蠕动泵(Vapourtec V-3)将反应物溶液泵入系统(每次0.277mL / min,停留时间为12分钟)。将溶液与交叉混合器(0.400 i.d.)混合,通过高温盘管反应器。离开反应器后,反应物流通过一小段不锈钢管使反应冷却,然后通过背压调节器离开系统(注意:PFA配件不应在出口处使用)反应器,因为它们会因反应流的高温而变形并导致系统泄漏。我们的系统中使用了不锈钢连接器和管道(1200)。在流动系统平衡18分钟后,收集产物流5分钟(2.77mmol苯胺)。将粗混合物溶于乙酸乙酯中并用盐水洗涤。将合并的有机层用硫酸镁干燥,过滤,并减压浓缩。通过柱色谱(Biotage 25g Ultra-sil,3e15%乙酸乙酯的己烷溶液)纯化残余物,得到所需产物。
4.2.1。 4-氯-N-甲基苯胺(3a)
307毫克(79%);黄油; 1H NMR(400MHz,CDCl3)d 7.20e7.07(m,2H),6.62e6.50(m,2H),3.85(br s,1H),2.82(s,3H)。 13 C NMR(101MHz,CDCl 3)d 147.6,129.0,122.0,113.6,30.9。 1H NMR光谱与文献报道的一致
4.2.2。 N-甲基-4-(三氟甲基)苯胺(3b)
359毫克(74%);清油; 1H NMR(400MHz,CDCl3)d 7.43(d,J = 8.4Hz,2H),6.68(d,J = 8.0Hz,2H),4.36(br s,1H),2.88(s,3H)。 13C NMR(101MHz,CDCl3)d 150.7,126.6(q,J = 3.9Hz),126.2,123.5,112.2,30.8。 1H NMR谱与文献报道的一致
4.2.3。 N,4-二甲基苯胺(3c)
168毫克(50%);清油; 1H NMR(400MHz,CDCl3)d 7.03(d,J = 7.9Hz,2H),6.56(d,J = 8.2Hz,2H),2.83(s,3H),2.27(s,3H)。 13 C NMR(101MHz,CDCl 3)d 146.8,129.7,126.8,112.9,31.3,20.4。 1H和13C NMR光谱与文献中报道的一致。
4.2.4。 4-(叔丁基)-N-甲基苯胺(3d)
183毫克(41%);清油; 1H NMR(400MHz,CDCl3)d 7.30e7.24(m,2H),6.81e6.72(m,2H),3.37(br s,1H),2.90e2.81(s,3H),1.29(s ,9H)。 13 C NMR(101MHz,CDCl 3)d 146.7,140.2,125.9,112.4,33.8,31.5,31.1。 IR(neat,cm 1)3410(m),3054(w),2959(m),2900(m),2868(m),2810(w),1700(w),1617(m),1520(s ),1488(m),1459(m),1392(w),1362(m),1348(m),1303(m),1262(m),1193(m),1155(m),1113(w ),1058(w),931(w),819(s),777(w),731(w),702(w)。 HRMS(m / z)[M H] C 11 H 18 N的计算值,164.1434;实测值:164.1434。发现,164.1435。
4.2.5。 N-甲基 - [1,10-联苯] -4-胺(3e)
323毫克(64%);黄色固体; 1H NMR(400MHz,CDCl3)d 7.55(d,J = 7.0Hz,2H),7.49(d,J = 8.4Hz,2H),7.40(t,J = 7.6Hz,2H),7.27(t,J frac14;7.4Hz,1H),6.79(d,J = 7.6 Hz,2H),3.42(br s,1H),2.91(s,3H)。 13 C NMR(101MHz,CDCl 3)d 147.5,141.1,131.4,128.6,128.0,126.4,126.2,113.6,31.4。 1H和13C NMR光谱与文献中报道的一致。
4.2.6。 4-碘-N-甲基苯胺(3f)
490毫克(76%);黄油; 1H NMR(400MHz,CDCl3)d 7.50e7.40(m,2H),6.47e6.44(m,2H),3.37(br s,1H),2.81(s,3H)。 13 C NMR(101MHz,CDCl 3)d 137.8,115.2,31.0。 IR(neat,cm 1)3418(m),3182(w),2984(w),2922(w),2879(m),2811(m),2571(w),2384(w),2295(w ),2118(w),18
资料编号:[4436]
您可能感兴趣的文章
- 选择性能量转移催化烯烃的含硼几何异构化外文翻译资料
- 瑞德西韦阻滞SARS-CoV-2聚合酶的作用机理外文翻译资料
- 铱催化的共轭二烯的C-H烯基的烯丙基化反应外文翻译资料
- 铱和布朗斯特酸协同催化烯丙醇对萘酚衍生物的对映选择性脱芳构化外文翻译资料
- 新型选择性MT2受体配体2-(苯硫基)苯并[b]噻吩类化合物的制备和药理学评价外文翻译资料
- Ilimaquinone是一种海绵代谢产物,通过gadd153介导的途径发挥抗癌作用外文翻译资料
- 用环境敏感药物释放的三氧化二砷靶向介孔二氧 化硅纳米颗粒有效治疗三阴性乳腺癌外文翻译资料
- 复方中草药对雄性荷斯坦犊牛生长表现,胴体特征和肉质的 影响外文翻译资料
- 线粒体在没有人体ATP合酶的亚基c时渗透性转 变的持久性外文翻译资料
- 基于呋喃类化合物构建环氧树脂 2,5-呋喃羧酸(FDCA)生物基环氧树脂的合成及性能研究外文翻译资料


