
英语原文共 9 页
二维辉钼矿作为吸附剂用于高效从水中去除Pb(Ⅱ)
摘要:由于富含硫且具有巨大表面积的特性,二维辉钼矿具备从水中去除铅的潜能。本项工作试图探讨二维辉钼矿作为一种超级吸附剂去除水中铅的可行性。通过吸附等温线和动力学试验以及SEM-EDS研究了辉钼矿/水界面Pb(Ⅱ)的吸附容量,并用XPS研究了吸附机理。结果表明,二维辉钼矿具有显着地去除水中Pb(Ⅱ)的效率,具有1479mg/g的吸附容量。吸附遵循Freundlich等温模型,并与准一级和准二级动力学模型拟合良好。吸附机理归因于Pb(Ⅱ)与二维辉钼矿表面上暴露的固有S或O原子络合的化学吸附,以及静电吸附作用。
- 简介
因为其独特的光学和电子特性与其本体辉钼矿相完全不同[1],在过去几年,二维辉钼矿已成为最热门的纳米材料之一。因为单层二硫化钼纳米片(由两片硫片和一片中间钼片组成)具有1.9 eV的直接带隙[2]的特点,使其含有巨大的潜能成为制造微电子器件、场效应晶体管、光电晶体管、模拟小信号放大器、化学品以及传感器、超灵敏光电探测器、太阳能电池和光催化剂[3-5]等物品的材料之一。然而,突出的性质仅存在于具有完美晶体结构的单层二硫化钼中,并且随着层厚度增加或晶格缺陷的发生这种性质会变得越来越差[6]。同时,大规模制备二维辉钼矿的方法有可能产生具有缺陷的单层辉钼矿或多层辉钼矿片。因此,这些二维辉钼矿在上述光电应用中并没有很大应用。所以,必须努力扩展这些二维辉钼矿纳米片的应用。
由于二维结构使辉钼矿具有超高的表面积,这使得二维辉钼矿成为理想的吸附剂并应用于环境修复中的可能性增大[7-9]。分子动力学模拟表明,在海水淡化中,纳米多孔二维辉钼矿能成为一种有效的的滤膜,可以防止盐离子并允许水以高速率通过纳米孔[10,11]。最近的研究表明,二维辉钼矿具有较强的吸附各种染料和有机污染物的能力[12,13]。这些发现涉及了二维辉钼矿在有机污染物上的吸附能力。
由于S配体和重金属之间的络合,硫磺涂层吸附剂在重金属去除中表现出良好的性能[14-16]。然而,这些吸附剂在硫化物涂层中易受到化学浸渍的干扰,并且由于表面上的硫磺数量有限从而导致去除效率大大受限。而二维辉钼矿具有大量的内在硫磺暴露在表面上,使其在去除重金属物时具有显着的优势。我们之前的原子力显微镜(AFM)研究确实证明,由于辉钼矿上的含有大量S原子,Hg2 可以有效地固定在二硫化钼/水的界面上[17]。同时,在天然物质上发现了非常高的二硫化钼纳米片去除Hg2 [18]的吸附能力。合成的二硫化钼纳米片甚至在吸附能力方面显示出更好的Hg2 去除应用潜力。例如,基于多孔MoS2的气凝胶和花状二硫化钼纳米片就分别具有1527mg/g和2563mg/g高Hg2 去除能力[19,20]。
然而,目前并没有发现关于水溶液的环境修复中用二硫化钼作为吸附剂吸附重金属的研究。关于二维辉钼矿对其他金属的捕获能力也一无所知。因此,基于二维辉钼矿的大捕获性能的考虑,扩展二维辉钼矿的应用对于去除其他重金属具有重要意义[21-23]。本项工作选择铅作为代表性重金属,以探索其他重金属在二维辉钼矿上的吸附。通过吸附动力学和等温线,以及pH和温度的调节对二硫化物对二氧化钼上Pb(Ⅱ)吸附的影响进行了彻底的研究。同时通过XPS和Zeta电位仪器测量给出对Pb(Ⅱ)吸附机理的理解。目的是探讨使用二维辉钼矿作为超吸附剂去除其他重金属的可行性。
- 试验
2.1.材料和试剂
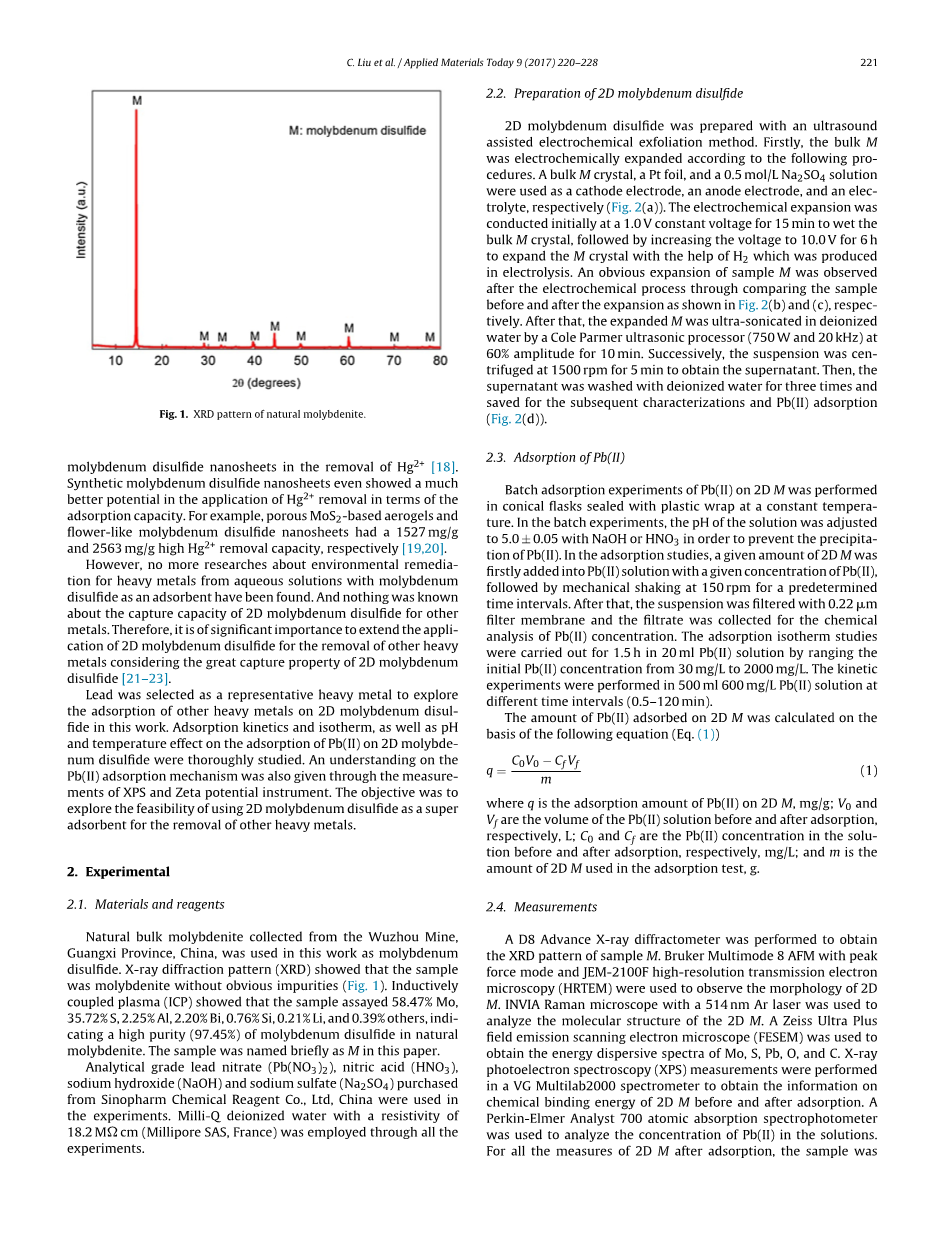
本项工作采用从中国广西梧州矿采集的天然块状辉钼矿作为实验样品。从样品的二硫化钼X射线衍射图(XRD)的分析结果可以看到,该辉钼矿样品没有明显的杂质(图1)。电感耦合等离子体(ICP)分析结果显示,样品成分分别为58.47%Mo,35.72%S,2.25%Al,2.20%Bi,0.76%Si,0.21%Li和0.39%其他。说明在该天然辉钼矿中含有高纯度(97.45%)的二硫化钼。该样本在以下文中简称为M.
同时,本项工作采用购自Sinopharm Chemical Reagent Co 的中国有限公司 的分析级硝酸铅( Pb(NO3)2),硝酸(HNO3),氢氧化钠(NaOH)和硫酸钠(Na2SO4)用于实验。采用Milli-Q、电阻率为18.2 MQ cm(Millipore SAS,France)的去离子水用于所有实验。
图1.天然辉钼矿的XRD图谱。
2.2. 二维二硫化钼的制备
用超声辅助电化学剥离法制备二维辉钼矿。首先,根据以下步骤将块M电化学膨胀。块M晶体,Pt箔和0.5mol / L Na2SO4 溶液分别用作阴极,阳极和电解质(图2(a))。电化学膨胀最初在1.0 V恒定电压下进行15分钟,以润湿本体M晶体,然后将电压增加至10.0V持续6小时以上,在H2 的帮助下使M晶体膨胀、电解。在电化学过程之后,通过比较膨胀之前和之后的样品,观察到样品M的明显膨胀,分别如图2(b)和(c)所示。接着,将扩展的M通过Cole Parmer超声处理器(750W和20kHz)以60%振幅在去离子水中超声处理10分钟。之后,将悬浮液以1500rpm的速率离心5分钟获得上清液。然后,将上清液用去离子水洗涤三次并保存,用于随后的表征和 Pb(Ⅱ)吸附实验(图2(d))。
图2. 2DM的制备。(a)在电化学膨胀实验装置的示意图,(b)和(c)分别为电化学膨胀之前和之后的样品M ,(d)2D M悬浮液。
2.3.Pb(Ⅱ)的吸附
Pb(Ⅱ)在2D M上的批量吸附实验在锥形烧瓶中进行,所述锥形烧瓶在恒温下用塑料膜密封包装。在批量实验中,先用NaOH或HNO3将溶液的pH调节至5.0plusmn;0.05,以防止Pb(Ⅱ)的沉淀。在吸附研究中,首先将定量的2D M加入到具有给定浓度的的Pb(Ⅱ)溶液中,然后在预定的时间间隔下以150rpm的速率下机械振荡。之后,用0.22mu;m滤膜过滤悬浮液,收集滤液用于Pb(Ⅱ)浓度的化学分析。将初始Pb(Ⅱ)浓度从30mg / L调节至2000mg / L,在20ml Pb(Ⅱ)溶液中进行吸附等温线研究1.5小时。动态实验在500ml 600mg/L Pb(Ⅱ)溶液中以不同的时间间隔( 0.5-120min)进行。吸收在2D M上的Pb(Ⅱ)的量基于以下等式计算(等式(1))。
其中q是Pb(Ⅱ)在2D M上的吸附量,单位为mg /g;V0和Vf分别是吸附前后Pb(Ⅱ)溶液的体积L;C0和Cf是吸附前后溶液中Pb(Ⅱ)的浓度,单位为mg /L;m是吸附试验中使用的2D M的量,单位为g。
2.4.测量
本项工作使用D8 Advance X射线衍射仪来获得样品M的XRD图。采用峰值力模式的Bruker Multimode 8 AFM和JEM-2100F高分辨率透射电子显微镜(HRTEM)用于观察2D的形态。使用具有514nm Ar激光的M. INVIA Raman显微镜分析2DM的分子结构。使用Zeiss Ultra Plus场发射扫描电子显微镜(FESEM)获得Mo,S,Pb,O和C的能量色散谱。X射线光电子能谱(XPS)测量在 VG Multilab2000光谱仪中进行,以获得吸附前后2D M的化学结合能的信息。使用Perkin-Elmer Analyst 700原子吸收分光光度计分析溶液中Pb(Ⅱ)的浓度。对于吸附后2D M的所有测量,样品均用去离子水小心洗涤三次,以除去表面上未吸附的离子。
- 结果和讨论
3.1.2D M的表征
图3中2D M的拉曼光谱在381和408 cmminus;1处显示两个强信号,分别分配给了面内E12g和面外A1g 振动的钼二硫化物[24]。两个特征峰表明在超声辅助电化学剥离M期间化学成分并没有发生变化。图4显示了2DM的TEM图像。良好的透光性表明了2DM的薄厚度范围从数百纳米到几微米。这说明天然辉钼矿成功地剥离成二维辉钼矿纳米片。在图4(a)和(b)中也观察到一些透明性差的2D M纳米片,这可能来自薄纳米片的重叠或二硫化钼的不完全剥离。
图3. 2D M的拉曼光谱。
图4. 2D M.的TEM图像
图5(a)显示了具有2D M沉积的云母表面的代表性AFM图像。从中可以清楚地观察到具有相似薄厚度的2D M纳米片。这些纳米片具有不同的宽度,范围从几十纳米到几百纳米。图5(b)显示了在图5(a)中用红线标记的2D M纳米片的相应高度的横截面轮廓。测量从基底到纳米片的台阶高度约为1.5nm,推断纳米片可能是双层二硫化钼,因为单层S-Mo-S的厚度结构约为0.7 nm [1]。随机选择200纳米片以对2D M的厚度分布研究,结果如图5(c)所示。结果表明,厚度为0.8~1.0nm的2D M约占4%,考虑到对AFM的轻微高估,推测可能是单层辉钼矿二硫化物薄片[25]。研究还显示超过56%的纳米片具有1.0至2.0nm的厚度,表明大多数2D M属于双层二硫化钼。还有少量2D M含有三个,四个或五个钼的二硫化物单元层。厚度超过5.0nm的2D M占21.5%,表明78.5%的 2D M纳米片具有薄的厚度(小于5个单位层)[26]。AFM结果很好地证明了大块辉钼矿在2D材料中的良好剥离。
图5:2D M的AFM结果:(a)2D M的代表性AFM图像,(b)2D M的相应高度横截面轮廓,(c)2D M片的厚度分布的直方图。
3.2.Pb(Ⅱ)在2D M上的吸附动力学
Pb(Ⅱ)在2D(M)上的吸附动力学在Pb(Ⅱ)溶液中进行,初始Pb(Ⅱ)浓度为600 mg/L,pH值为5.0。2DM的Pb(Ⅱ)吸附容量随吸附时间的变化如图6所示。可以看出,在前15分钟内,吸附以非常高的速率进行,在20分钟内就达到平衡。这可能是因为2D M上的吸附位点的完全暴露使得Pb(Ⅱ)通过快速膜扩散接近2D M的表面,因此,在2DM上观察到极高的Pb(Ⅱ)吸附。从该观点来看,2D M可能可以作为潜在吸附剂从水溶液中去除Pb(Ⅱ)。实验数据分别用伪一级(方程(2))和伪二级(方程(3))动力学模型[27]模拟。拟一级动力学模型基于固体吸附容量,而拟二级动力学模型广泛用于水溶液中金属离子的吸附。
其中t是吸附时间;qe和qt分别为在平衡时和在t时间时Pb(Ⅱ)吸附容量对2D M的影响;k1和k2分别是伪一阶和伪二阶速率常数。拟合结果在表1中已给出。参数qe表明,从伪一级和伪二级模型计算出的Pb(Ⅱ)在2D M上的平衡吸附容量分别为 136.33mg/g 和 144.91mg/ g,两者均接近实验结果(137.63mg/g)。此外,两种模型的拟合度R2均高于0.98,表明Pb(Ⅱ)在2D M上的吸附动力学遵循伪一阶和伪二阶模型。
图6.在20 ◦C和pH 5.0的2D M上Pb(Ⅱ)的吸附动力学,初始Pb(Ⅱ)浓度为600 mg / L.
表格1
3.3. Pb(Ⅱ)在2D M上的吸附等温线
在20 ◦C和35 ◦C时2D M对Pb(Ⅱ)平衡浓度的吸附能力如图7(a)所示。随着Pb(Ⅱ)浓度的增加,吸附容量也相应增加,直至达到平衡。吸附等温线表明2DM在Pb(Ⅱ)上具有巨大的吸附能力。在温度35 ◦C时,Pb(Ⅱ)平衡浓度约为800 mg/L,当2D M作为吸附剂时可获得1479 mg/ g Pb(Ⅱ)吸收能力。其他文献中报道的吸附剂的Pb(Ⅱ)吸附容量列于表2中以供比较。用于去除Pb(Ⅱ)的常规吸附剂的最大容量小于300mg/g。即使对于有吸附力的氧化石墨烯吸附剂,其Pb(Ⅱ)捕获量也约为768mg/g。同时,也有基于MoS2而制成吸附剂去除Pb(Ⅱ)的研究,然而,结果表明它的吸附能力(660.67mg/g)相较于本研究中的表现要低得多。造成这种结果的原因可能是由于在MoS2表面合成CoFe2O4时,引入了Fe3 、 Mn2 和Co2 ,占据了大部分关于MoS2的吸附位点。上述结果表明2D M具有比其他吸附剂更好的对Pb(Ⅱ)的亲和力。
表2
假设化学计量S / Pb比为1:1,估计单层二硫化钼对Pb(Ⅱ)的理论吸附容量为2587mg/g。如果每个S原子被一个Pb原子覆盖,则图5(c)所示厚度的2D M的吸收能力约为1083mg/g。Pb(Ⅱ)在2DM上的多层吸附使得在实验中获得了比理论预测值更高的捕获量。即使在20 ◦C、高Pb(Ⅱ)平衡浓度下,也没有明显观察到吸附平衡,这也表明2DM具有优异的吸附性能。图7(a)显示当温度从20 ◦C增加到35 ◦C时,2D M的Pb(Ⅱ)吸附量更高,该结论表明了2D M吸附Pb(Ⅱ)在温度上依赖性。用 Langmuir(Eq.( 4 )), Freundlich( Eq.( 5 ))和Temkin等温模型(Eq.(6))的线性形式进一步模拟实验数据,如图7(b)-(d)、表3所示.
其中q


